
ΓΨΧβΡΩΓΩ‘ΎNa+≈®Ε»ΈΣ0.5molL©¹1ΒΡΡ≥≥Έ«ε»ή“Κ÷–Θ§ΜΙΩ…ΡήΚ§”–œ¬±μ÷–ΒΡ»τΗ…÷÷άκΉ”Θ°
Θ®“―÷ΣH2SiO3ΈΣ≤Μ»ή”ΎΥ°ΒΡΫΚΉ¥≥ΝΒμΘ§Φ”»» ±“ΉΖ÷ΫβΈΣΝΫ÷÷―θΜ·ΈοΘ©
―τάκΉ” | K+ | Ag+ | Ca2+ | Ba2+ |
“θάκΉ” | NO3©¹ | CO32©¹ | SiO32©¹ | SO42©¹ |
œ÷»ΓΗΟ»ή“Κ100mLΫχ––»γœ¬ Β―ιΘ®ΤχΧεΧεΜΐΨυ‘Ύ±ξΉΦΉ¥Ωωœ¬≤βΕ®Θ©Θ°
–ρΚ≈K] | Β―ιΡΎ»ί | Β―ιΫαΙϊ |
Δώ | œρΗΟ»ή“Κ÷–Φ”»κΉψΝΩœΓ―ΈΥα | ≤ζ…ζΑΉ…ΪΫΚΉ¥≥ΝΒμ≤ΔΖ≈≥ω±ξΉΦΉ¥Ωωœ¬0.56LΤχΧε |
Δρ | ΫΪΔώΒΡΖ¥”ΠΜλΚœ“ΚΙΐ¬ΥΘ§Ε‘≥ΝΒμœ¥Β”ΓΔΉΤ…’÷ΝΚψ÷ΊΘ§≥ΤΝΩΥυΒΟΙΧΧε÷ ΝΩ | ΙΧΧε÷ ΝΩΈΣ2.4g |
Δσ | œρΔρΒΡ¬Υ“Κ÷–ΒΈΦ”BaCl2»ή“Κ | ΈόΟςœ‘œ÷œσ |
«κΜΊ¥πœ¬Ν–Έ ΧβΘ°
Θ®1Θ© Β―ιΔώΡή»ΖΕ®“ΜΕ®≤Μ¥φ‘ΎΒΡάκΉ” «ΘΜ
Θ®2Θ© Β―ιΔώ÷–…ζ≥…ΤχΧεΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΜ
Θ®3Θ©Ά®Ιΐ Β―ιΔώΓΔΔρΓΔΔσΚΆ±Ί“ΣΦΤΥψΘ§Χν–¥œ¬±μ÷–“θάκΉ”ΒΡ≈®Ε»Θ®ΡήΦΤΥψ≥ωΒΡΘ§Χν–¥ΦΤΥψΫαΙϊΘ§“ΜΕ®≤Μ¥φ‘ΎΒΡάκΉ”ΧνΓΑ0Γ±Θ§≤ΜΡή»ΖΕ® «Ζώ¥φ‘ΎΒΡάκΉ”ΧνΓΑΘΩΓ±Θ©Θ°
“θάκΉ” | NO3©¹ | CO32©¹ | SiO32©¹ | SO42©¹ |
c/molL©¹1 |
ΓΨ¥πΑΗΓΩΘ®1Θ©Ag+ΓΔCa2+ΓΔBa2+ΘΜ
Θ®2Θ©CO32©¹+2H+=H2O+CO2ΓϋΘΜ
Θ®3Θ©
“θάκΉ” | NO3©¹ | CO32©¹ | SiO32©¹ | SO42©¹ |
c/molL©¹1 | ΘΩ | 0.25 | 0.4 | 0 |
ΓΨΫβΈωΓΩ
‘ΧβΖ÷ΈωΘΚΗυΨί»ή“ΚΈΣ≥Έ«ε»ή“ΚΩ…÷ΣΘΚ»ή“Κ÷–Κ§”–ΒΡάκΉ”“ΜΕ®ΡήΙΜ¥σΝΩΙ≤¥φΘΜ”… Β―ιΔώΩ…÷ΣΘ§ΗΟ»ή“Κ÷–“ΜΕ®Κ§”–CO32-Θ§Τδ≈®Ε»ΈΣ![]() =0.25mol/LΘ§‘ρ“ΜΕ®ΟΜ”–Ag+ΓΔMg2+ΓΔBa2+ΘΜ”……ζ≥…ΑΉ…Ϊ≥ΝΒμ≈–Εœ»ή“Κ÷–“ΜΕ®Κ§”–SiO32-Θ§ΖΔ…ζΖ¥”ΠSiO32-+2H+=H2SiO3ΓΐΘ§ΙηΥαΦ”»»Ζ÷Ϋβ…ζ≥…Εΰ―θΜ·ΙηΘ§ΙΧΧε÷ ΝΩΈΣ2.4gΈΣΕΰ―θΜ·ΙηΒΡ÷ ΝΩΘ§ΗυΨίΙη‘≠Ή” ΊΚψΘ§SiO32-ΒΡ≈®Ε»ΈΣ
=0.25mol/LΘ§‘ρ“ΜΕ®ΟΜ”–Ag+ΓΔMg2+ΓΔBa2+ΘΜ”……ζ≥…ΑΉ…Ϊ≥ΝΒμ≈–Εœ»ή“Κ÷–“ΜΕ®Κ§”–SiO32-Θ§ΖΔ…ζΖ¥”ΠSiO32-+2H+=H2SiO3ΓΐΘ§ΙηΥαΦ”»»Ζ÷Ϋβ…ζ≥…Εΰ―θΜ·ΙηΘ§ΙΧΧε÷ ΝΩΈΣ2.4gΈΣΕΰ―θΜ·ΙηΒΡ÷ ΝΩΘ§ΗυΨίΙη‘≠Ή” ΊΚψΘ§SiO32-ΒΡ≈®Ε»ΈΣ![]() =0.4mol/LΘΜ”… Β―ιΔσΩ…÷Σ»ή“Κ÷–≤ΜΚ§SO42-Θ§ΗυΨίΒγΚ… ΊΚψ2cΘ®CO32-Θ©+2cΘ®SiO32-Θ©=2ΓΝ0.25mol/L+2ΓΝ0.4mol/L=1.3mol/LΘΨ0.5mol/LΘ§“ρ¥Υ»ή“Κ÷–“ΜΕ®Κ§”–K+Θ§«“Τδ≈®Ε»÷Ν…ΌΈΣ0.8mol/LΘ§≤ΜΡή»ΖΕ®NO3- «Ζώ¥φ‘ΎΘΜ
=0.4mol/LΘΜ”… Β―ιΔσΩ…÷Σ»ή“Κ÷–≤ΜΚ§SO42-Θ§ΗυΨίΒγΚ… ΊΚψ2cΘ®CO32-Θ©+2cΘ®SiO32-Θ©=2ΓΝ0.25mol/L+2ΓΝ0.4mol/L=1.3mol/LΘΨ0.5mol/LΘ§“ρ¥Υ»ή“Κ÷–“ΜΕ®Κ§”–K+Θ§«“Τδ≈®Ε»÷Ν…ΌΈΣ0.8mol/LΘ§≤ΜΡή»ΖΕ®NO3- «Ζώ¥φ‘ΎΘΜ
Θ®1Θ©”… Β―ιΔώΩ…÷ΣΘ§Φ”»κΉψΝΩœΓ―ΈΥα…ζ≥…ΑΉ…Ϊ≥ΝΒμ≤Δ‘Ύ±ξΉΦΉ¥Ωωœ¬Ζ≈≥ω0.56LΤχΧεΘ§‘ρΗΟ»ή“Κ÷–“ΜΕ®Κ§”–CO32-ΓΔSiO32-Θ§‘ρ“ΜΕ®ΟΜ”–Ag+ΓΔMg2+ΓΔBa2+ΘΜ
Θ®2Θ©Φ”»κ―ΈΥαΘ§…ζ≥…ΤχΧεCO2ΒΡάκΉ”Ζ¥”ΠΈΣCO32©¹+2H+=H2O+CO2ΓϋΘΜ
Θ®3Θ©ΗυΨί…œ ωΖ÷ΈωΙΐ≥ΧΘ§ΒΟΒΫΘΚ
“θάκΉ” | NO3- | CO32- | SiO32- | SO42- |
c/molL-1 | ΘΩ | 0.25 | 0.4 | 0 |
ΓΘ


 ΨΌ“ΜΖ¥»ΐΆ§≤Ϋ«…Ϋ≤ΨΪΝΖœΒΝ–¥πΑΗ
ΨΌ“ΜΖ¥»ΐΆ§≤Ϋ«…Ϋ≤ΨΪΝΖœΒΝ–¥πΑΗ ΩΎΥψ”κ”Π”ΟΧβΩ®œΒΝ–¥πΑΗ
ΩΎΥψ”κ”Π”ΟΧβΩ®œΒΝ–¥πΑΗ Οϊ ΠΒψΨΠΉ÷¥ ΨδΕΈΤΣœΒΝ–¥πΑΗ
Οϊ ΠΒψΨΠΉ÷¥ ΨδΕΈΤΣœΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΜ·―ß‘Ύ…ζΜν÷–”–Ή≈ΙψΖΚΒΡ”Π”ΟΓΘœ¬Ν–Ε‘”ΠΙΊœΒ¥μΈσΒΡ «Θ® Θ©
―Γœν | Μ·―ß–‘÷ | ΒΦ ”Π”Ο |
A | Al2(SO4)3ΚΆ–ΓΥ’¥ρΖ¥”Π | ≈ίΡ≠ΟπΜπΤςΟπΜπ |
B | Χζ±»Ά≠Ϋπ τ–‘«Ω | FeCl3Η· ¥CuΩΧ÷Τ”ΓΥΔΒγ¬ΖΑε |
C | ¥Έ¬»Υα―ΈΨΏ”–―θΜ·–‘ | Τ·ΑΉΖέΤ·ΑΉ÷·Έο |
D | ““ΥαΨΏ”–Υα–‘ | ≥Θ”Ο”Ύ»Ξ≥ΐΥ°ΙΗ |
A. A B. B C. C D. D
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ100Γφ ±Θ§ΫΪ0.1molN2O4÷Ο”Ύ1LΟή±’»ίΤς÷–Θ§»ΜΚσΫΪ…’ΤΩΖ≈»κ100ΓφΒΡΚψΈ¬≤έ÷–Θ§…’ΤΩΡΎΒΡΤχΧε÷πΫΞ±δΈΣΚλΉΊ…ΪΘΚN2O4(g) ![]() 2NO2(g)ΓΘœ¬Ν–Ϋα¬έ≤ΜΡήΥΒΟς…œ ωΖ¥”Π‘ΎΗΟΧθΦΰœ¬“―Ψ≠¥οΒΫΖ¥”ΠœόΕ»ΒΡ «
2NO2(g)ΓΘœ¬Ν–Ϋα¬έ≤ΜΡήΥΒΟς…œ ωΖ¥”Π‘ΎΗΟΧθΦΰœ¬“―Ψ≠¥οΒΫΖ¥”ΠœόΕ»ΒΡ «
AΘ°N2O4ΒΡœϊΚΡΥΌ¬ ”κNO2ΒΡ…ζ≥…ΥΌ¬ ÷°±»ΈΣ1:2
BΘ°…’ΤΩΡΎΤχΧεΒΡ―’…Ϊ≤Μ‘ΌΦ”…ν
CΘ°…’ΤΩΡΎΤχΧεΒΡΤΫΨυœύΕ‘Ζ÷Ή”÷ ΝΩ≤Μ‘Ό±δΜ·
DΘ°…’ΤΩΡΎΤχΧεΒΡ―Ι«Ω≤Μ‘Ό±δΜ·
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν– ¬ Β≤ΜΡή”Οά’œΡΧΊΝ–‘≠άμΫβ ΆΒΡ «
A. Fe(SCN)3»ή“Κ÷–¥φ‘ΎFe3++3SCNΘ≠![]() Fe(SCN)3Θ§œρ¥Υ»ή“Κ÷–Φ”»κΙΧΧεKSCNΚσ―’…Ϊ±δ…ν
Fe(SCN)3Θ§œρ¥Υ»ή“Κ÷–Φ”»κΙΧΧεKSCNΚσ―’…Ϊ±δ…ν
B. ”ΟΆ®Ιΐ Δ±ΞΚΆ ≥―ΈΥ°ΒΡœ¥ΤχΤΩά¥≥ΐ»Ξ¬»Τχ÷–ΒΡ…ΌΝΩHClΤχΧε‘”÷
C. Ζ¥”ΠCO(g)+NO2(g)![]() CO2(g)+NO(g)Θ®’ΐΖ¥”ΠΈΣΖ≈»»Ζ¥”ΠΘ©ΓΘ¥οΤΫΚβΚσΘ§…ΐΗΏΈ¬Ε»ΧεœΒ―’…Ϊ±δ…ν
CO2(g)+NO(g)Θ®’ΐΖ¥”ΠΈΣΖ≈»»Ζ¥”ΠΘ©ΓΘ¥οΤΫΚβΚσΘ§…ΐΗΏΈ¬Ε»ΧεœΒ―’…Ϊ±δ…ν
D. Κœ≥…Α±ΘΚN2(g)+3H2(g)![]() 2NH3(g) ΓςHΘΦ0‘ΎΗΏΈ¬ΓΔΗΏ―ΙΚΆ¥ΏΜ·ΦΝΧθΦΰœ¬Ϋχ––
2NH3(g) ΓςHΘΦ0‘ΎΗΏΈ¬ΓΔΗΏ―ΙΚΆ¥ΏΜ·ΦΝΧθΦΰœ¬Ϋχ––
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ…ηNAΈΣΑΔΖϋΦ”Β¬¬ό≥Θ ΐΒΡ÷ΒΘ§œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
AΘ°1L pH=lΒΡΝρΥα»ή“Κ÷–Κ§”–ΒΡH+ ΐΡΩΈΣ0.2NA
BΘ°1 molτ«Μυ”κl mol«β―θΗυάκΉ”ΥυΚ§÷ Ή” ΐΨυΈΣ9NA
CΘ° 14 g”…N2”κCOΉι≥…ΒΡΜλΚœΤχΧε÷–Κ§”–ΒΡ‘≠Ή” ΐΡΩΈΣ2NA
DΘ°±ξΉΦΉ¥Ωωœ¬Θ§2.24 L Cl2»ή”ΎΥ°Θ§ΉΣ“ΤΒΡΒγΉ” ΐΡΩΈΣ0.1NA
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩtΓφ ±Θ§ΫΪ3molAΚΆ1molBΤχΧεΆ®»κ»ίΜΐΈΣ2LΒΡΟή±’»ίΤς÷–Θ®»ίΜΐ≤Μ±δΘ©Θ§ΖΔ…ζ»γœ¬Ζ¥”Π3A(g)+B(g) ![]() xC(g)Θ§2min ±Ζ¥”ΠΒΫ¥οΤΫΚβΉ¥Χ§Θ®Έ¬Ε»≤Μ±δΘ©Θ§¥Υ ±»ίΤςΡΎ Θ”ύΝΥ0.8molBΘ§≤Δ≤βΒΟCΒΡ≈®Ε»ΈΣ0.4molΓΛLΘ≠1ΓΘ«κΧν–¥œ¬Ν–Ω’ΑΉΘΚ
xC(g)Θ§2min ±Ζ¥”ΠΒΫ¥οΤΫΚβΉ¥Χ§Θ®Έ¬Ε»≤Μ±δΘ©Θ§¥Υ ±»ίΤςΡΎ Θ”ύΝΥ0.8molBΘ§≤Δ≤βΒΟCΒΡ≈®Ε»ΈΣ0.4molΓΛLΘ≠1ΓΘ«κΧν–¥œ¬Ν–Ω’ΑΉΘΚ
Θ®1Θ©¥”Ζ¥”ΠΩΣ ΦΒΫΤΫΚβΉ¥Χ§Θ§…ζ≥…CΒΡΤΫΨυΖ¥”ΠΥΌ¬ ΈΣ ΓΘ
Θ®2Θ©x= ΓΘ
Θ®3Θ©»τœρ‘≠ΤΫΚβΜλΚœΈοΒΡ»ίΤς÷–‘Ό≥δ»κamolCΘ§‘ΎtΓφ ±¥οΒΫ–¬ΒΡΤΫΚβΘ§¥Υ ±BΒΡΈο÷ ΒΡΝΩΈΣn(B)= molΓΘ
Θ®4Θ©±Θ≥÷Έ¬Ε»ΚΆΧεΜΐ≤Μ±δΘ§Ε‘‘≠ΤΫΚβΜλΚœΈο÷–»ΐ’ΏΒΡΈο÷ ΒΡΝΩΉς»γœ¬Βς’ϊΘ§Ω… ΙΤΫΚβœρ”““ΤΕ·ΒΡ « Θ®ΧνΉ÷ΡΗΘ©ΓΘ
AΘ°ΨυΦθΑκ BΘ°ΨυΦ”±Ε CΘ°Ψυ‘ωΦ”0.4mol DΘ°ΨυΦθ–Γ0.4mol
Θ®5Θ©»γΙϊ…œ ωΖ¥”Π‘ΎœύΆ§Έ¬Ε»ΚΆ»ίΜΐΒΡ»ίΤς÷–Ϋχ––Θ§Τπ ΦΦ”»κ3molAΚΆ3molBΘ§¥οΒΫΤΫΚβ ±AΒΡΧεΜΐΖ÷ ΐΈΣa%ΓΘΤδΥϋΧθΦΰ≤Μ±δ ±Θ§Α¥œ¬Ν–≈δ±»ΉςΈΣΤπ ΦΈο÷ Θ§ΤΫΚβ ±AΒΡΧεΜΐΖ÷ ΐ¥σ”Ύa%ΒΡ « Θ®ΧνΉ÷ΡΗΘ©ΓΘ
AΘ°2molC BΘ°1molAΓΔ3molBΚΆ4molC
CΘ°1molBΚΆ4molC DΘ°6molAΚΆ2molB
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΙβΒγ≥Ί «ΖΔ’Ι–‘Ρή‘¥ΓΘ“Μ÷÷ΙβΜ·―ßΒγ≥ΊΒΡΫαΙΙ»γΆΦΘ§Β±Ιβ’’‘Ύ±μΟφΆΩ”–¬»Μ·“χΒΡ“χΤ§…œ ±Θ§AgCl Θ®sΘ© ![]() Ag Θ®sΘ©+ClΘ®AgClΘ©Θ§ΘέClΘ®AgClΘ©±μ Ψ…ζ≥…ΒΡ¬»‘≠Ή”ΈϋΗΫ‘Ύ¬»Μ·“χ±μΟφΘίΘ§Ϋ”Ή≈ClΘ®AgClΘ©+eΘ≠=ClΘ≠ Θ®aqΘ©Θ§»τΫΪΙβ‘¥“Τ≥ΐΘ§Βγ≥ΊΜαΝΔΦ¥Μ÷Η¥÷Ν≥θ ΦΉ¥Χ§ΓΘœ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «
Ag Θ®sΘ©+ClΘ®AgClΘ©Θ§ΘέClΘ®AgClΘ©±μ Ψ…ζ≥…ΒΡ¬»‘≠Ή”ΈϋΗΫ‘Ύ¬»Μ·“χ±μΟφΘίΘ§Ϋ”Ή≈ClΘ®AgClΘ©+eΘ≠=ClΘ≠ Θ®aqΘ©Θ§»τΫΪΙβ‘¥“Τ≥ΐΘ§Βγ≥ΊΜαΝΔΦ¥Μ÷Η¥÷Ν≥θ ΦΉ¥Χ§ΓΘœ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «
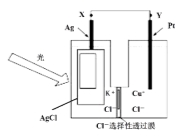
AΘ°Ιβ’’ ±Θ§ΒγΝς”…XΝςœρY
BΘ°Ιβ’’ ±Θ§PtΒγΦΪΖΔ…ζΒΡΖ¥”ΠΈΣΘΚ2ClΘ≠+2eΘ≠=Cl2Γϋ
CΘ°Ιβ’’ ±Θ§ClΘ≠œρPtΒγΦΪ“ΤΕ·
DΘ°Ιβ’’ ±Θ§Βγ≥ΊΉήΖ¥”ΠΈΣΘΚAgClΘ®sΘ©+Cu+Θ®aqΘ©![]() AgΘ®sΘ©+Cu2+Θ®aqΘ©+ClΘ≠Θ®aqΘ©
AgΘ®sΘ©+Cu2+Θ®aqΘ©+ClΘ≠Θ®aqΘ©
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–œ÷œσ τ”ΎΈοάμ±δΜ·ΒΡ «
A. ≥±Ϋβ B. ΒγΫβ C. Υ°Ϋβ D. Ν―Ϋβ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ―«¬»ΥαΡΤ(NaClO2) «“Μ÷÷ΗΏ–ß―θΜ·ΦΝΚΆ”≈÷ Τ·ΑΉΦΝΓΘ“Μ÷÷“‘¬»ΥαΡΤ(NaClO3)ΈΣ‘≠Νœ÷Τ±ΗNaClO2¥÷ΤΖΒΡΙΛ“’Νς≥Χ»γœ¬ΆΦΥυ ΨΘΚ
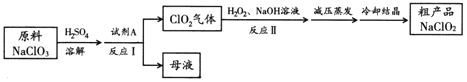
“―÷ΣΘΚ
ΔΌ¥ΩClO2“ΉΖ÷ΫⱧ’®Θ§Ω’Τχ÷–ClO2ΒΡΧεΜΐΖ÷ ΐ‘Ύ10%“‘œ¬±»ΫœΑ≤»ΪΘΜ
ΔΎNaClO2‘ΎΦν–‘»ή“Κ÷–Έ»Ε®¥φ‘ΎΘ§‘ΎΥα–‘»ή“Κ÷–―ΗΥΌΖ÷ΫβΘΜ
ΔέΚ§Υ°NaClO2 ή»»“ΉΖ÷ΫβΓΘ
(1) ‘ΦΝAΩ…“‘―Γ‘ώ___________(ΧνΉ÷ΡΗ–ρΚ≈)ΓΘ
a. SO2 b. ≈®œθΥα c. KMnO4
(2) œ¬Ν–ΙΊ”Ύ…œ ωΝς≥ΧΒΡΥΒΖ®÷–Θ§ΚœάμΒΡ «________(ΧνΉ÷ΡΗ–ρΚ≈)ΓΘ
a. Ζ¥”ΠΔώΫχ––Ιΐ≥Χ÷–”Π≥÷–χΙΡ»κΩ’Τχ
b. Ζ¥”ΠΔώΚσΒΟΒΫΒΡΡΗ“Κ÷–Θ§»ή÷ ΒΡ÷ς“Σ≥…Ζ÷ «NaCl
c. Ζ¥”ΠΔρ÷–NaOH ”ΠΙΐΝΩ
(3) Ζ¥”ΠΔρΒΡάκΉ”ΖΫ≥Χ ΫΈΣ ΓΘ
(4) “―÷Σ―Ι«Ω‘Ϋ¥σΘ§Έο÷ ΒΡΖ–Βψ‘ΫΗΏΓΘΖ¥”ΠΔρΫα χΚσ≤…”ΟΓΑΦθ―Ι’τΖΔΓ±≤ΌΉςΒΡ‘≠“ρ «_________________ΓΘ
(5) NaClO2±δ÷ Ω…Ζ÷ΫβΈΣNaClO3ΚΆNaClΓΘ»ΓΒ»÷ ΝΩ±δ÷ «ΑΚσΒΡNaClO2 ‘―υΨυ≈δ≥…»ή“ΚΘ§Ζ÷±π”κΉψΝΩFeSO4»ή“ΚΖ¥”Π ±Θ§œϊΚΡFe2+ΒΡΈο÷ ΒΡΝΩ ΓΘΘ®ΧνΓΑœύΆ§Γ±Θ§ΓΑ≤ΜΆ§Γ±ΜρΓΑΈόΖ®≈–ΕœΓ±Θ©
(6) ÷–Φδ≤ζΈοΕΰ―θΜ·¬»(ClO2)‘Ύ…ζ≤ζ…ζΜν÷–“≤”–ΙψΖΚ”Π”ΟΓΘ”ΟClO2¥Πάμ–Ι¬©ΒΡ«ηΜ·ΡΤ(NaCN)Θ§ΒΟΒΫΈόΕΨΒΡNaClΓΔN2 ΚΆCO2ΓΘ»τ¥ΠάμΚ§NaCN 4ΓΝ10-5mol ΓΛL-1ΒΡΖœΥ° 1000LΘ§÷Ν…Ό–η“ΣClO2 ΒΡ÷ ΝΩΈΣ___________gΓΘ
(7) ClO2 «“Μ÷÷ΗΏ–ßΥ°¥ΠάμΦΝΘ§Ω…”Ο―«¬»ΥαΡΤΚΆœΓ―ΈΥαΈΣ‘≠Νœ÷Τ±ΗΓΘ–¥≥ωΗΟ÷Τ±ΗΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΙζΦ ―ß–Θ”≈―Γ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com