
【题目】下列现象属于物理变化的是
A. 潮解 B. 电解 C. 水解 D. 裂解
科目:高中化学 来源: 题型:
【题目】
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下:
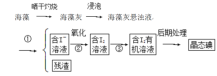
(1)写出提取碘的过程中有关实验操作的名称:①______;③________。
(2)提取碘的过程中可供选择的有机溶剂是
A.汽油、酒精
B.四氯化碳、汽油
C.醋酸、酒精
(3)为完成以上①、③两步操作,实验室里有烧杯、玻璃棒、铁架台、烧瓶、导管、酒精灯,尚缺少的玻璃仪器是____________________________________。
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图所示的实验装置中的错误之处:① ,② ,③ ,④ 。
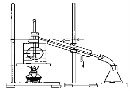
(5)为便于控制蒸馏时的温度,操作时使用水浴加热,最后晶体碘在________里聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na+浓度为0.5molL﹣1的某澄清溶液中,还可能含有下表中的若干种离子.
(已知H2SiO3为不溶于水的胶状沉淀,加热时易分解为两种氧化物)
阳离子 | K+ | Ag+ | Ca2+ | Ba2+ |
阴离子 | NO3﹣ | CO32﹣ | SiO32﹣ | SO42﹣ |
现取该溶液100mL进行如下实验(气体体积均在标准状况下测定).
序号K] | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色胶状沉淀并放出标准状况下0.56L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题.
(1)实验Ⅰ能确定一定不存在的离子是;
(2)实验Ⅰ中生成气体的离子方程式为;
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”).
阴离子 | NO3﹣ | CO32﹣ | SiO32﹣ | SO42﹣ |
c/molL﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列描述正确的是
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.40gNaOH溶解在1L水中,所制得的溶液,物质的量浓度为1molL﹣1
C.标准状况下,11.2L四氯化碳所含分子数为0.5NA
D.常温常压下,5.6g铁与过量的盐酸反应转移电子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CH4可用于设计燃料电池,甲烷燃料电池的工作原理如图(左)所示:原电池工作过程中OH-的作用是_______________;负极电极反应式为:_____________。若电路中转移电子数为0.8NA,左侧溶液中pH________(填“增大”,“减小”,”不变”)(忽略溶液体积的变化),右侧的OH-物质的量变化量为_________。
(2)CH4与H2O在隔绝空气、高温和催化剂条件下反应:
CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=m kJ·mol—1
CO(g)+3H2(g) ΔH=m kJ·mol—1
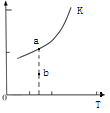
则反应的平衡常数表达式K=______________,K的大小与温度(T)的关系如上图(右)中曲线所示,则m__________0(填“>”“=”或“<”);改变某一条件,使状态从a点到达b点,若保持温度不变,反应再次达到平衡时,则CH4的转化率___________(填“增大”、“减小”、“不变”或“不确定”),反应的焓变(△H)将_______________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实现下列变化的有机反应的类型,不正确的是( )
A. CH3CH3→CH3CH2Cl 取代反应
B. CH2=CH2→CH2BrCH2Br 加成反应
C. CH2=CH2→CH3CH2OH 取代反应
D. CH≡CH→CHBr=CHBr 加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,向2 L恒容密闭容器中充入1 mol PCl5,发生反应:PCl5(g) ![]() PCl3(g)+Cl2(g) ,一段时间后达到平衡。部分数据见下表,下列说法正确的是
PCl3(g)+Cl2(g) ,一段时间后达到平衡。部分数据见下表,下列说法正确的是
t / s | 0 | 50 | 150 | 250 | 350 |
n(PCl3) / mol | 0 | 0. 16 | 0. 19 | 0. 2 | 0. 2 |
A.0~50 s内平均速率v(PCl3)= 0. 0032 mol·L-1·s-1
B.其他条件不变,升高温度,平衡时c(PCl3)= 0. 11 mol·L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1mol PCl5、0. 2 mol PCl3 和0. 2 mol Cl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2 mol PCl3 、2 mol Cl2,达到平衡时PCl3 的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,试管中各有10 mL相同浓度的盐酸(如下图),同时将两个侧管中的物质 全部倒入各自的试管中,下列叙述正确的是

A.甲装置的气球膨胀速率大
B.若最终两气球体积相同,则一定有c(HCl)≥2molL-1
C.若最终两气球体积不同,则一定有c(HCI)≤lmolL-1
D.最终两溶液中Na+、C1-的物质的量相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com