
【题目】(1)CH4可用于设计燃料电池,甲烷燃料电池的工作原理如图(左)所示:原电池工作过程中OH-的作用是_______________;负极电极反应式为:_____________。若电路中转移电子数为0.8NA,左侧溶液中pH________(填“增大”,“减小”,”不变”)(忽略溶液体积的变化),右侧的OH-物质的量变化量为_________。
(2)CH4与H2O在隔绝空气、高温和催化剂条件下反应:
CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=m kJ·mol—1
CO(g)+3H2(g) ΔH=m kJ·mol—1
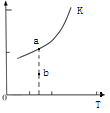
则反应的平衡常数表达式K=______________,K的大小与温度(T)的关系如上图(右)中曲线所示,则m__________0(填“>”“=”或“<”);改变某一条件,使状态从a点到达b点,若保持温度不变,反应再次达到平衡时,则CH4的转化率___________(填“增大”、“减小”、“不变”或“不确定”),反应的焓变(△H)将_______________(填“增大”、“减小”或“不变”)。
【答案】(1)参与电极反应,定向移动形成电流(各1分,共2分);
CH4-8e-+10OH-=CO3-+7H2O(2分);不变(1分);0.2mol(2分)
(2)![]() (2分);>(2分);不确定(2分);不变(2分)
(2分);>(2分);不确定(2分);不变(2分)
【解析】
试题分析:(1)甲烷失去电子转化为CO2,CO2结合氢氧根生成碳酸根,则氢氧根的作用是参与电极反应,定向移动形成电流;负极通入甲烷,电极反应式为CH4-8e-+10OH-=CO3-+7H2O;。若电路中转移电子数为0.8NA,正极消耗氧气是0.2mol,生成氢氧根是0.8mol,由于生成的氢氧根向负极移动,所以左侧溶液中pH不变”。根据负极电极反应式可知右侧甲烷消耗1mol氢氧根,所以右侧的OH-物质的量变化量为1mol-0.8mol=0.2mol。
(2)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据方程式CH4(g)+H2O(g)![]() CO(g)+3H2(g)可知反应的平衡常数表达式K=
CO(g)+3H2(g)可知反应的平衡常数表达式K=![]() ,根据图像可知升高温度K增大,所以正反应是吸热反应,m>0;由于不能确定改变的条件,所以使状态从a点到达b点,若保持温度不变,反应再次达到平衡时,不能确定CH4的转化率如何变化;焓变只与反应物和生成物总能量的相对大小有关系,所以△H不变。
,根据图像可知升高温度K增大,所以正反应是吸热反应,m>0;由于不能确定改变的条件,所以使状态从a点到达b点,若保持温度不变,反应再次达到平衡时,不能确定CH4的转化率如何变化;焓变只与反应物和生成物总能量的相对大小有关系,所以△H不变。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂。摩尔盐隔绝空气加热可完全分解生成红棕色固体和其他产物。某学习小组欲探究其分解产物。
I.甲组同学设计了如下实验装置。

(1)实验中,装置B中观察到的现象是____________________。
(2)碱石灰的主要作用是__________________。
(3)装置D中观察到酚酞溶液变红色,由此可知摩尔盐分解的产物中有_____________(写化学式)。
(4)设计实验验证装置A中固体残留物不含FeO:___________________(简要说明实验操作、现象和结论)。
Ⅱ.乙组同学认为摩尔盐受热分解的产物中还含有SO2、SO3和N2。为进行验证,用甲组实验中的装置A和下列所示装置进行实验。

(5)乙组同学的实验装置中,依次连接的合理顺序为A、__________。装置G中盐酸的作用是_________________。
(6)实验中,准确称量摩尔盐7.8400 g,充分加热反应后,测得装置A中固体残留物的质量为1.6000 g,装置G中生成白色沉淀的质量为3.4950 g,装置H中收集到112 mL N2(标准状况下),写出摩尔盐受热分解的化学方程式:___________________。(分解产物被充分吸收,不考虑其损失)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将3molA和1molB气体通入容积为2L的密闭容器中(容积不变),发生如下反应3A(g)+B(g) ![]() xC(g),2min时反应到达平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol·L-1。请填写下列空白:
xC(g),2min时反应到达平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol·L-1。请填写下列空白:
(1)从反应开始到平衡状态,生成C的平均反应速率为 。
(2)x= 。
(3)若向原平衡混合物的容器中再充入amolC,在t℃时达到新的平衡,此时B的物质的量为n(B)= mol。
(4)保持温度和体积不变,对原平衡混合物中三者的物质的量作如下调整,可使平衡向右移动的是 (填字母)。
A.均减半 B.均加倍 C.均增加0.4mol D.均减小0.4mol
(5)如果上述反应在相同温度和容积的容器中进行,起始加入3molA和3molB,达到平衡时A的体积分数为a%。其它条件不变时,按下列配比作为起始物质,平衡时A的体积分数大于a%的是 (填字母)。
A.2molC B.1molA、3molB和4molC
C.1molB和4molC D.6molA和2molB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法不正确的是


A. 由红外光谱可知,该有机物中至少有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C. 仅由核磁共振氢谱无法得知其分子中的氢原子总数
D. 若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 二糖的水解产物一定是葡萄糖和果糖 B. 生物大分子就是指多糖
C. 蔗糖和麦芽糖是动植物体内都有的二糖 D. 单糖是不能再水解的糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2在光照射下可使水分解:2H2O![]() 2H2↑+O2↑,该过程类似植物的光合作用。如图是光照射下TiO2分解水的装置示意图。下列叙述正确的是
2H2↑+O2↑,该过程类似植物的光合作用。如图是光照射下TiO2分解水的装置示意图。下列叙述正确的是

A.该装置可以将光能转化为电能,同时也能转化为化学能
B.TiO2电极上发生的反应为:2H++2e-=H2↑
C.该装置工作时,电流由TiO2电极经R流向铂电极
D.该装置工作时,TiO2电极附近溶液的pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如图:

回答下列问题:
(1)经过步骤①后,加入NaOH固体的原因是 .
(2)步骤②反应的离子方程式是 .
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为 .
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示,试推测曲线Ⅰ比曲线Ⅱ对应的污水pH (填“高”或“低”).

(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的 (填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是 (答出两点即可).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com