
【题目】有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,试管中各有10 mL相同浓度的盐酸(如下图),同时将两个侧管中的物质 全部倒入各自的试管中,下列叙述正确的是

A.甲装置的气球膨胀速率大
B.若最终两气球体积相同,则一定有c(HCl)≥2molL-1
C.若最终两气球体积不同,则一定有c(HCI)≤lmolL-1
D.最终两溶液中Na+、C1-的物质的量相同
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效氧化剂和优质漂白剂。一种以氯酸钠(NaClO3)为原料制备NaClO2粗品的工艺流程如下图所示:
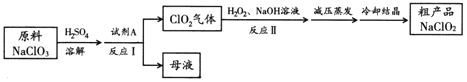
已知:
①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全;
②NaClO2在碱性溶液中稳定存在,在酸性溶液中迅速分解;
③含水NaClO2受热易分解。
(1) 试剂A可以选择___________(填字母序号)。
a. SO2 b. 浓硝酸 c. KMnO4
(2) 下列关于上述流程的说法中,合理的是________(填字母序号)。
a. 反应Ⅰ进行过程中应持续鼓入空气
b. 反应Ⅰ后得到的母液中,溶质的主要成分是NaCl
c. 反应Ⅱ中NaOH 应过量
(3) 反应Ⅱ的离子方程式为 。
(4) 已知压强越大,物质的沸点越高。反应Ⅱ结束后采用“减压蒸发”操作的原因是_________________。
(5) NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 。(填“相同”,“不同”或“无法判断”)
(6) 中间产物二氧化氯(ClO2)在生产生活中也有广泛应用。用ClO2处理泄漏的氰化钠(NaCN),得到无毒的NaCl、N2 和CO2。若处理含NaCN 4×10-5mol ·L-1的废水 1000L,至少需要ClO2 的质量为___________g。
(7) ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该制备反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下:

已知:CaO2·8H2O呈白色微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全。
(1)写出反应①屮氧化还原反应的离子方程式___________________。
(2)向反应①后的溶液中加浓氨水的目的是_________________。
(3)写出反应②的化学方程式_________________;反应②常用冰水控制温度在0℃左右.其可能原因是(写出两种):
①________________;②________________。
(4)测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加人适量蒸馏水和过量的b gKI晶体,再滴人少量2 mol L-1H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加人几滴淀粉溶液。
第三步:逐滴加入浓度为c mol L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。已知:I2+2S2O32- =2I-+S4O62-。
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能__________(填“不受影响”“偏低”或“偏高”),原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关检测生物组织中糖类、脂肪和蛋白质实验的叙述,正确的是
A. 斐林试剂的甲液与双缩脲试剂的A液的化学成分是相同的
B. 还原糖和蛋白质的鉴定过程都需要水浴加热
C. 检测生物组织中的还原糖时可采用西瓜汁作材料
D. 检测花生子叶中的脂肪实验时,可用稀盐酸洗去浮色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | |
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是___________(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是__________
A.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
B.ClO-+CH3COOH=CH3COO-+HClO
C.CO32-+HClO=CO2↑+H2O+ClO-
D.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是___________
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH) C.c(H+)/ KW D.c(H+)/c(OH-)

(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化如图,则HX的电离平衡常数___________(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的 c(H+)______________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或 “小于”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com