
【题目】下列关于组成细胞的化合物的叙述正确的是
A. 蛋白质分子中的N主要存在于氨基中
B. 糖原的最终代谢产物是葡萄糖
C. 组成ATP、DNA、RNA的元素种类完全相同
D. 脂肪分子中含H比糖类多,是主要的能源物质
科目:高中化学 来源: 题型:
【题目】将50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答问题:
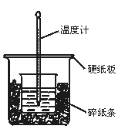
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”,下同),所求中和热 ,简述理由: 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50 mol·L-1醋酸代替盐酸进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂。摩尔盐隔绝空气加热可完全分解生成红棕色固体和其他产物。某学习小组欲探究其分解产物。
I.甲组同学设计了如下实验装置。

(1)实验中,装置B中观察到的现象是____________________。
(2)碱石灰的主要作用是__________________。
(3)装置D中观察到酚酞溶液变红色,由此可知摩尔盐分解的产物中有_____________(写化学式)。
(4)设计实验验证装置A中固体残留物不含FeO:___________________(简要说明实验操作、现象和结论)。
Ⅱ.乙组同学认为摩尔盐受热分解的产物中还含有SO2、SO3和N2。为进行验证,用甲组实验中的装置A和下列所示装置进行实验。

(5)乙组同学的实验装置中,依次连接的合理顺序为A、__________。装置G中盐酸的作用是_________________。
(6)实验中,准确称量摩尔盐7.8400 g,充分加热反应后,测得装置A中固体残留物的质量为1.6000 g,装置G中生成白色沉淀的质量为3.4950 g,装置H中收集到112 mL N2(标准状况下),写出摩尔盐受热分解的化学方程式:___________________。(分解产物被充分吸收,不考虑其损失)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒温恒压容器,乙为恒温恒容容器。初始时,两容器的温度、体积相同,两容器中均充入2molSO2和1molO2,且发生反应为2SO2(g)+O2(g) ![]() 2SO3(g);△H<0;当两容器都达到平衡后,为使两者中的SO2在平衡混合物中的物质的量分数相同,下列措施中不可行的是
2SO3(g);△H<0;当两容器都达到平衡后,为使两者中的SO2在平衡混合物中的物质的量分数相同,下列措施中不可行的是
A.向甲容器中再充入一定量的氦气 B.向乙容器中再充入2mol的SO3气体
C.适当降低乙容器的温度 D.增大甲容器的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. Fe(SCN)3溶液中存在Fe3++3SCN-![]() Fe(SCN)3,向此溶液中加入固体KSCN后颜色变深
Fe(SCN)3,向此溶液中加入固体KSCN后颜色变深
B. 用通过盛饱和食盐水的洗气瓶来除去氯气中的少量HCl气体杂质
C. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g)(正反应为放热反应)。达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应)。达平衡后,升高温度体系颜色变深
D. 合成氨:N2(g)+3H2(g)![]() 2NH3(g) △H<0在高温、高压和催化剂条件下进行
2NH3(g) △H<0在高温、高压和催化剂条件下进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将3molA和1molB气体通入容积为2L的密闭容器中(容积不变),发生如下反应3A(g)+B(g) ![]() xC(g),2min时反应到达平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol·L-1。请填写下列空白:
xC(g),2min时反应到达平衡状态(温度不变),此时容器内剩余了0.8molB,并测得C的浓度为0.4mol·L-1。请填写下列空白:
(1)从反应开始到平衡状态,生成C的平均反应速率为 。
(2)x= 。
(3)若向原平衡混合物的容器中再充入amolC,在t℃时达到新的平衡,此时B的物质的量为n(B)= mol。
(4)保持温度和体积不变,对原平衡混合物中三者的物质的量作如下调整,可使平衡向右移动的是 (填字母)。
A.均减半 B.均加倍 C.均增加0.4mol D.均减小0.4mol
(5)如果上述反应在相同温度和容积的容器中进行,起始加入3molA和3molB,达到平衡时A的体积分数为a%。其它条件不变时,按下列配比作为起始物质,平衡时A的体积分数大于a%的是 (填字母)。
A.2molC B.1molA、3molB和4molC
C.1molB和4molC D.6molA和2molB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法不正确的是


A. 由红外光谱可知,该有机物中至少有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C. 仅由核磁共振氢谱无法得知其分子中的氢原子总数
D. 若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如图:

回答下列问题:
(1)经过步骤①后,加入NaOH固体的原因是 .
(2)步骤②反应的离子方程式是 .
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为 .
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如图曲线Ⅰ、Ⅱ所示,试推测曲线Ⅰ比曲线Ⅱ对应的污水pH (填“高”或“低”).

(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的 (填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是 (答出两点即可).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com