
【题目】下列有关实验装置的说法中正确的是
A.用图甲装置可以测量乙醇与钠反应后生成氢气的体积
B.用图乙装置可以验证氯气与水反应有盐酸生成
C.用图丙装置可以比较苏打和小苏打的热稳定性 
D.用图丁装置可以验证溴乙烷与NaOH醇溶液共热产生了乙烯
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e—结构。写出其电子式_____________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阴极区与生成的氯气反应产生少量三氯化氮,该反应的化学方程式为______________。
(2)已知:2CO2(g) + 3NaOH(aq)=NaHCO3(aq)+Na2CO3(aq)+H2O(l) △H=-4a kJ/mol
CO2(g) +2NaOH(aq)=Na2CO3(aq)+H2O(l) △H=-b kJ/mol
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:____________。
(3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(CO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(CO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(CO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
②该反应的△H______0(填“>”或“<”)。
③甲、丙容器达到平衡时,CO的转化率为α(甲)________α(乙)(填“>”,“< ”,“=”)
(4)常温下,在(NH4)2C2O4溶液中,反应NH4++C2O42—+H2O![]() NH3·H2O+HC2O4—的平衡常数K=___。(已知常温下,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5 H2O的电离平衡常数Kw=1×10-14 NH3·H2O的电离平衡常数Kb≈2×10-5)
NH3·H2O+HC2O4—的平衡常数K=___。(已知常温下,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5 H2O的电离平衡常数Kw=1×10-14 NH3·H2O的电离平衡常数Kb≈2×10-5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
(1)从氯化钾溶液中得到氯化钾固体,选择装置____________(填代表装置图的字母,下同);除去自来水中的Cl等杂质,选择装置________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________。
(3)装置A中仪器①的名称是________,装置B中仪器②的名称是________。
(4)为了除去KCl中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的KCl,可将混合物溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序进行提纯,正确的步骤及顺序是___________。
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液
⑤加过量BaCl2溶液 ⑥加过量KOH溶液 ⑦加过量K2CO3溶液
A.②⑤④①③ B.⑥⑤⑦①③ C.④①②⑤③ D.④②⑤①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)A原子的核外电子排布式:____________________________________________________。
(2)B元素在周期表中的位置:________________________________________________;离子半径:B________(填“大于”或“小于”)A。
(3)C原子的电子排布图是__________________,其原子核外有________个未成对电子,能量最高的电子为________轨道上的电子,其轨道呈________形。
(4)D-的结构示意图是________。
(5)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为________________________________________________________________________。与D的氢化物的水化物反应的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速度来滴定该浓氯水,根据测定结果绘制出ClO-、ClO3-等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是

A. NaOH溶液和浓氯水可以使用同种滴定管盛装
B. a点溶液中存在如下关系:c(Na+)+c(H+)=c(ClO-)+c(ClO3-)+c(OH-)
C. b点溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)
D. t2~t4,ClO-的物质的量下降的原因可能是ClO-自身歧化:2ClO-=Cl-+ClO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物所含的官能团种类和结构会决定有机物的性质。
(1)多巴胺是一种神经传导物质,可影响人的情绪,其结构简式如图所示。

①多巴胺分子中官能团的名称为_____(填两种)。
②1 mol多巴胺最多可以消耗_____mol溴水中的Br2。
③多巴胺分子通常需要密封保存,其原因是_____。
(2)化合物D是合成一种心脏病药物的中间体,合成它的路线如下:
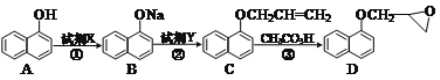
①A分子中含_____种化学环境不同的氢。试剂X的化学式可以是_____。化合物D中含氧官能团的名称为_____。
②试剂Y的分子式为C3H5Cl,其结构简式为_____。
③化合物E是A的一种同分异构体,其分子中含有苯环,能发生银镜反应,能与溴水发生加成反应,分子中有4种不同化学环境的氢原子。任写一种符合条件的化合物E的结构简式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是一种药物的中间体,其合成的部分路线如下:
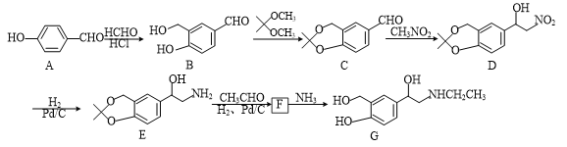
(1)C→D的反应类型是___反应。
(2)化合物F的分子式为C14H21NO3,写出F的结构简式:___。
(3)化合物A与HCHO反应还可能生成的副产物是___。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:___。
①分子中含有苯环,能与NaHCO3溶液反应;
②含有一个手性碳原子。
(5)根据已有知识并结合相关信息,写出以![]() 、CH3NO2为原料制备
、CH3NO2为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。_______________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,某混合烃和过量
时,某混合烃和过量![]() 在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃不可能是下面哪种情况
在一密闭容器中完全反应,测知反应前后的压强没有变化,则该混合烃不可能是下面哪种情况 ![]()
![]()
A.CH4和C2H4体积比1:1B.C2H2和C2H6体积比1:1
C.C2H4和C3H4体积比1:2D.C3H4和C3H6体积比1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaF2、CaC2都是工业生产的重要物质。回答下列问题:
(1)基态钙原子的电子排布式___________,钙原子核外有___________种能量状态的电子。
(2)CaC2与水反应生成乙炔(C2H2),乙炔中碳原子的杂化类型为___________,乙炔中的σ键与π键数之比为___________。
(3)CaF2与浓H2SO4反应生成HF,HF的沸点高于C2H2,原因是:___________;HF能的BF3化合得到HBF4,从化学键形成角度分析HF与BF3能化合的原因___________。
(4)NO2F分子与BF3互为等电子体,则NO2F分子的立体构型为______________________。
(5)CaF2的晶胞为立方晶胞,结构如下图所示:

①CaF2晶胞中,Ca2+的配位数为___________个。
②“原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的“原子坐标参数”为(___________,___________,![]() )
)
③晶胞中两个F-的最近距离为273.1pm,用NA表示阿伏加德罗常数,则晶胞的密度为___________g/cm3(列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com