
【题目】化学与生活、环境密切相关,下列有关说法正确的是![]()
![]()
A.我国在南海成功开采的可燃冰![]() 可能会带来酸雨等环境污染
可能会带来酸雨等环境污染
B.大量使用含丙烷、二甲醚等辅助成分的“空气清新剂”,会对环境造成新的污染
C.在人体内酶的作用下,纤维素可以发生水解反应生成葡萄糖
D.我国全面启动的北斗导航系统的信号传输与硅有关
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】以NA表示阿伏加德罗常数的值,下列说法错误的是( )
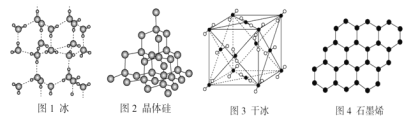
A.18 g冰(图1)中含O—H键数目为2NA
B.28 g晶体硅(图2)中含有Si—Si键数目为2NA
C.44 g干冰(图3)中含有4NA个CO2分子
D.石墨烯(图4)是碳原子单层片状新材料,12 g石墨烯中含C—C键数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇又称“木醇”,是无色有酒精气味易挥发的有毒液体。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g)![]() CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g)![]() CO2(g)+2H2(g) △H=Q2kJ·mol-1
CO2(g)+2H2(g) △H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为______。
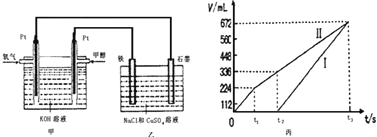
某同学设计了一个甲醇燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4混合溶液,其装置如图:
(2)为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为___________________________________。
(3)过量氯气用Na2S2O3除去,反应中S2O32-被氧化为SO42-。若过量的氯气为1×10-3mol,则理论上生成的SO42-为_____________mol。
(4)写出甲中通入甲醇这一极的电极反应式______________________。
(5)理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式____________,原混合溶液中 NaCl的物质的量浓度为___________mol/L。(设溶液体积不变)
(6)当向上述甲装置中通入标况下的氧气336mL时,理论上在铁电极上可析出铜的质量为_____________g。
(7)若使上述电解装置的电流强度达到5.0A,理论上每分钟应向负极通入气体的质量为_____________克。(已知1个电子所带电量为1.6×10-19C,计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2(g)+3H2(g)![]() 2NH3(g)反应过程中能量变化如图所示,下列有关叙述正确
2NH3(g)反应过程中能量变化如图所示,下列有关叙述正确
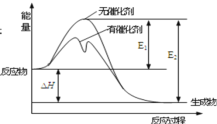
A.该反应正反应的活化能小于逆反应的活化能
B.该反应的逆反应为放热反应
C.使用催化剂使该反应的反应热发生改变
D.该反应的ΔH=E2-E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池具有广阔的发展前途,科学家近年研制出一种微型的燃料电池,采用甲醇取代氢气做燃料可以简化电池设计,该电池有望取代传统电池。某学生在实验室利用碱性甲醇燃料电池电解Na2SO4溶液。
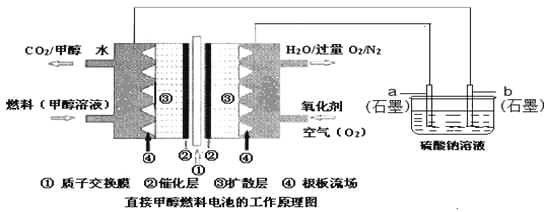
请根据图示回答下列问题:
(1)图中a电极是______(填“正极”、“负极”、“阴极”或“阳极”)。该电极上发生的电极反应式为_________________________________________。
(2)碱性条件下,通入甲醇的一极发生的电极反应式为____________________________。
(3)当消耗3.36 L氧气时(已折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是__。
(4)25℃、101kPa时,燃烧16g甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.“一代材料,一代飞机”,据悉2017年国产大飞机C919中使用了素有“现代工业骨骼”之称的碳纤维,碳纤维是一种新型的有机高分子材料
B.离子交换膜在工业上应用广泛,如在氯碱工业中使用的阴离子交换膜
C.雾霾是一种分散系,带活性炭口罩的原理是吸附作用
D.煤炭经蒸馏,气化,液化等过程,可获得清洁能源和重要的化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中, a、b为石墨电极,通电一段时间后,b极附近显红色。下列说法不正确的是

A. b电极反应式为2H++2e-=H2↑B. a电极反应式为2Cl--2e-=Cl2↑
C. 铁电极反应式为Cu2++2e-=CuD. 铜电极反应式为4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)H2A在水中存在以下平衡:H2AH++HA-,HA-H++A2-.NaHA溶液显酸性,则溶液中离子浓度的大小顺序为_____。
(2)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2-(aq),滴加少量Na2A固体,c(Ca2+)_____(填“增大”“减小”或“不变”)。
(3)含有![]() 的废水毒性较大,某工厂废水中含4.00×10-3 molL-1的
的废水毒性较大,某工厂废水中含4.00×10-3 molL-1的![]() 。为使废水能达标排放,作如下处理:
。为使废水能达标排放,作如下处理:![]()
![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
①该废水中加入绿矾(FeSO47H2O)和稀硫酸时发生反应的离子方程式为:_____。
②已知:Ksp[Fe(OH)3]≈1.0×10-38 molL-1,Ksp[Cr(OH)3]≈1.0×10-31 molL-1,逐渐加入石灰水时,首先产生的沉淀是_____(填沉淀的化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl2·2CO·2H2O
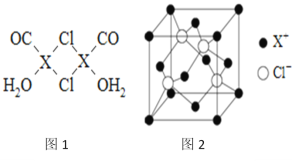
(1)X基态原子的电子排布式为__________________.
(2)C、H、O三种原子的电负性由大到小的顺序为__________.
(3)X2Cl2·2CO·2H2O是一种配合物,其结构如图1所示:
①与CO为互为等电子体的分子是_________.
②该配合物中氯原子的杂化方式为__________.
③在X2Cl22CO2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键_____________.
(4)阿伏加德罗常数的测定有多种方法,X射线衍射法就是其中的一种。通过对XCl晶体的X射线衍射图象的分析,可以得出XCl的晶胞如图2所示,则距离每个X+最近的Cl﹣的个数为____________,若X原子的半径为a pm,晶体的密度为ρg/cm3,试通过计算阿伏加德罗常数NA=___________________(列计算式表达)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com