
【题目】(1)H2A在水中存在以下平衡:H2AH++HA-,HA-H++A2-.NaHA溶液显酸性,则溶液中离子浓度的大小顺序为_____。
(2)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)Ca2+(aq)+A2-(aq),滴加少量Na2A固体,c(Ca2+)_____(填“增大”“减小”或“不变”)。
(3)含有![]() 的废水毒性较大,某工厂废水中含4.00×10-3 molL-1的
的废水毒性较大,某工厂废水中含4.00×10-3 molL-1的![]() 。为使废水能达标排放,作如下处理:
。为使废水能达标排放,作如下处理:![]()
![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
①该废水中加入绿矾(FeSO47H2O)和稀硫酸时发生反应的离子方程式为:_____。
②已知:Ksp[Fe(OH)3]≈1.0×10-38 molL-1,Ksp[Cr(OH)3]≈1.0×10-31 molL-1,逐渐加入石灰水时,首先产生的沉淀是_____(填沉淀的化学式)。
【答案】c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) 减小 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O Fe(OH)3
【解析】
(1)H2A是二元弱酸,发生两步电离,第一步电离程度远远大于第二步电离,NaHA溶液显酸性,说明HA-电离程度大于水解程度,钠离子不水解,再结合电荷守恒分析解答;
(2)加入Na2A固体,c(A2-)增大,抑制CaA溶解;
(3)①酸性条件下,Cr2O72-具有强氧化性,亚铁离子具有还原性,二者发生氧化还原反应生成铬离子和铁离子;
②Ksp[Fe(OH)3]≈1.0×10-38 molL-1,Ksp[Cr(OH)3]≈1.0×10-31 molL-1,前者较小,溶解度小,先生成沉淀。
(1)H2A是二元弱酸,其发生两步电离,且第一步电离程度远远大于第二步电离,NaHA溶液显酸性,说明HA-电离程度大于水解程度,且其程度都较小,钠离子不水解,HA-和水电离都生成氢离子,只有HA-电离生成A2-,所以离子浓度大小顺序是c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故答案为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);
(2)加入Na2A固体,c(A2-)增大,从而导致溶解平衡CaA(s)![]() Ca2+(aq)+A2-(aq)左移,c(Ca2+)减小,故答案为:减小;
Ca2+(aq)+A2-(aq)左移,c(Ca2+)减小,故答案为:减小;
(3)①酸性条件下,Cr2O72-具有强氧化性,亚铁离子具有还原性,二者发生氧化还原反应生成铬离子和铁离子,离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②由①溶液中Fe3+的浓度Cr3+是的3倍,已知:Ksp[Fe(OH)3]≈1.0×10-38 molL-1,Ksp[Cr(OH)3]≈1.0×10-31 molL-1,前者较小,溶解度小,逐渐加入石灰水时,首先产生的沉淀是Fe(OH)3(填沉淀的化学式)。故答案为:Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图所示),下列有关说法正确的是( )
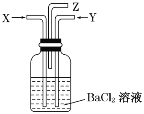
A.洗气瓶中产生的沉淀是碳酸钡
B.在Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是亚硫酸钡
D.在Z导管口有红棕色气体出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、环境密切相关,下列有关说法正确的是![]()
![]()
A.我国在南海成功开采的可燃冰![]() 可能会带来酸雨等环境污染
可能会带来酸雨等环境污染
B.大量使用含丙烷、二甲醚等辅助成分的“空气清新剂”,会对环境造成新的污染
C.在人体内酶的作用下,纤维素可以发生水解反应生成葡萄糖
D.我国全面启动的北斗导航系统的信号传输与硅有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下N2与H2反应生成NH3,已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、945.7 kJ,则N2与H2反应生成NH3的热化学方程式为:_____。
(2)N2H4和H2O2混合可作火箭推进剂,已知:16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ 的热量,反应N2H4(l)+O2(g)=N2(g)+2H2O(l)的△H=_____kJmol-1。
已知:2H2O2(l)=O2(g)+2H2O(l) △H=-196.4 kJmol-1.N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为_____。
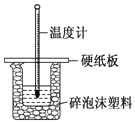
(3)实验室用50 mL 0.50 molL-1盐酸与50 mL某浓度的NaOH溶液在如下图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有一处明显的错误,该处错误是缺少一种玻璃仪器,该仪器的名称为_____;实验室提供了0.50 molL-1和0.55 molL-1两种浓度的NaOH溶液,应选择_____ molL-1的溶液进行实验。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是 ( )
A.通常状况下,氯气是一种黄绿色有毒的气体,在加压条件下转化为液态,可储存在钢瓶中,便于运输和使用
B.通常状况下,碘单质是紫黑色的固体,易升华,遇淀粉溶液,溶液会变蓝色
C.镁是一种活泼的金属,一旦失火,若用泡沫灭火器灭火反而会燃烧得更旺
D.![]() 是一种白色晶体,溶于水,溶液呈弱碱性,所以是医学上治疗胃酸过多的一种试剂
是一种白色晶体,溶于水,溶液呈弱碱性,所以是医学上治疗胃酸过多的一种试剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL0.1mol·L-1NaOH溶液中加入0.1mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A.b点所示溶液中[A-]>[HA]
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,[Na+]=[A-]+[HA]
D.a点所示溶液中[Na+]>[A-]>[H+]>[HA]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是( )
A.工夫茶主要程序有治壶、投茶、出浴、淋壶、烫杯、酾茶、品茶等其中涉及的操作方法有:溶解、萃取、过滤、蒸馏
B.含棉、麻、丝、毛及合成纤维的废旧衣物燃烧处理时都只生成![]() 和
和![]()
C.工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料
D.港珠澳大桥设计使用寿命120年,水下钢柱镶铝块防腐的方法为牺牲阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.恒温时,向水中加入少量固体硫酸氢钠,c(H+)增大,水的离子积常数Kw不变
B.0.1mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.对于N2(g)+3H2(g)![]() 2NH3(g),其他条件不变,充入N2,正反应速率增大,逆反应速率减小
2NH3(g),其他条件不变,充入N2,正反应速率增大,逆反应速率减小
D.在硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
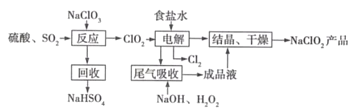
回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式_______。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com