
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
| A、温度升高时,K值增大 |
| B、恒温恒容下,增大压强,H2浓度可能增大、减小或不变 |
| C、升高温度,逆反应速率减小 |
| D、该反应化学方程式为:CO(g)+3H2(g)?CH4 (g)+H2O(g) |
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |


科目:高中化学 来源: 题型:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
| A、当容器中气体的密度不变时,说明该反应已达到平衡状态 |
| B、用O2表示0~4 min内该反应的平均速率为0.005 mol/(L?min) |
| C、若升高温度,则SO2的反应速率会变大,平衡常数K值会增大 |
| D、平衡时再通入18O2,平衡右移,再次平衡时各物质均含有18O,O2的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| pH | c(CrO
| c(HCrO
| c(Cr2O
| c(H2CrO4) | ||||||
| 4 | 0.0003 | 0.1040 | 0.4480 | 0 | ||||||
| 6 | 0.0319 | 0.0999 | 0.4370 | 0 | ||||||
| 7 | 0.2745 | 0.0860 | 0.3195 | 0 | ||||||
| 9 | 0.9960 | 0.0031 | 0.0004 | 0 |
A、铬酸第一级电离方程式为H2CrO4═H++HCrO
| ||||
| B、该铬酸溶液的物质的量浓度约为1 mol?L-1 | ||||
C、要得到CrO
| ||||
D、当电离达到平衡时,2v正(HCrO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使酚酞试液变红的溶液中:Na+ Cl- SO42- Fe3+ |
| B、c(H+)=10-12mol/L的溶液:K+ Ba2+ Cl- Br- |
| C、使紫色石蕊试液变红的溶液中:Fe2+ Mg2+ NO3- Cl- |
| D、碳酸氢钠溶液:K+ SO42- Cl- H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、46 g乙醇中含有的化学键数为7 NA |
| B、1 mol OH- 和1 mol-OH(羟基)中含有的质子数均为 9 NA |
| C、22.4L氯气和足量NaOH溶液反应转移电子数为NA |
| D、0.1 mol?L-1 FeCl3溶液制成胶体,含有Fe(OH)3胶粒数一定小于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2NO(g)+O2(g)?2NO2(g) |
| B、N2O4 (g)?2NO2(g) |
| C、Br2(g)+H2(g)?2HBr(g) |
| D、6NO(g)+4NH3(g)?5N2(g)+3H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
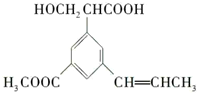
| A、该有机物的一个分子中属于不饱和碳原子的有6个,属于饱和碳原子的有8个 |
| B、该分子能与浓溴水反应生成白色沉淀 |
| C、1 mol该有机物与足量NaOH或H2反应,最多消耗2 mol NaOH,6 mol H2 |
| D、推测该有机物可能发生的反应有:加成反应、氧化反应、消去反应、水解反应、酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、23g钠在氧气中完全燃烧失去电子数为0.5NA |
| B、标准状况下,22.4L己烷中共价键数目为19NA |
| C、32g O3和O2的混合气体中共有2NA个氧原子 |
| D、6.8g熔融的KHSO4中含有0.1NA个阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 构建知识网络是学习化学的重要方法.下列物质的转化网络可以概括几类反应,其中A、B、D、E、M、N、X、Y均表示一种中学化学中常见的无机物,反应②、③、④、⑤的生成物可以是一种或几种.请回答下列问题:
构建知识网络是学习化学的重要方法.下列物质的转化网络可以概括几类反应,其中A、B、D、E、M、N、X、Y均表示一种中学化学中常见的无机物,反应②、③、④、⑤的生成物可以是一种或几种.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com