
【题目】溴化钙易溶于水,医学上可用于治疗神经衰弱、癫痫等症。
请回答下列问题:
Ⅰ.工业上溴的制备。
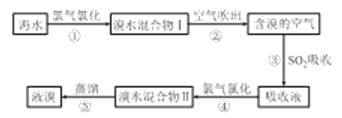
(1)步骤③中主要反应的化学方程式为___________________。
(2)不能直接用“溴水混合物I ”进行蒸馏得到液溴,原因是_________________。
Ⅱ.实验室溴化钙的制备。

(3)“合成”步骤中,所需装置最合适的是_____________(填选项字母)。

(4)“合成”步骤中的反应方程式为__________,“合成”步骤中需控制温度不能过高,原因是______________________,投料时控制n(Br2);n(NH3)=1:0.8,其目的是________________。
(5)步骤⑧酸化时应加入的酸是_________________。
(6)设计实验测定产品(主要成分CaBr2)纯度(不必描述操作过程的细节,物理量的数值可用字母表示):
______________________________。
【答案】 SO2+Br2+2H2O═H2SO4+2HBr 浓度较低,如果直接蒸馏,处理量大,生产成本高 B 3Ca(OH)2+3Br2+2NH3═3CaBr2+N2↑+6H2O 温度过高,Br2、NH3易挥发 确保Br2被充分还原 HBr(或氢溴酸或溴化氢) 取样品ɑ g,加水溶解滴入足量Na2CO3溶液充分反应后过滤,洗涤、干燥、冷却,称量,得到b g碳酸钙,则样品的纯度为![]() ×100%(其他合理答案也给分)
×100%(其他合理答案也给分)
【解析】试题分析:(1)步骤③中溴与二氧化硫反应生成硫酸、氢溴酸。
(2) “溴水混合物I ” 浓度较低。
(3)液溴、液氨易挥发“合成”步骤中需要控制反应在降低温度下进行。
(4)“合成”步骤中液氨、液溴先反应生成氮气和溴化氢,溴化氢与石灰乳反应生成溴化钙;温度过高,Br2、NH3易挥发,反应中Br2、NH3的系数比是3:2,投料时控制n(Br2);n(NH3)=1:0.8,氨气过量,确保Br2被充分还原。
(5)产品是溴化钙,为提高产品纯度步骤⑧酸化时应加入的酸是氢溴酸。
(6) 取样品ɑ g,加水溶解滴入足量Na2CO3溶液充分反应生成碳酸钙根据得到碳酸钙的质量,计算产品纯度。
解析:(1)步骤③中溴与二氧化硫反应生成硫酸、氢溴酸,反应方程式为SO2+Br2+2H2O═H2SO4+2HBr。
(2) “溴水混合物I ” 浓度较低,如果直接蒸馏,处理量大,生产成本高。
(3)液溴、液氨易挥发“合成”步骤中需要控制反应在降低温度下进行,最适宜的装置是B;
(4)“合成”步骤中液氨、液溴先反应生成氮气和溴化氢,溴化氢与石灰乳反应生成溴化钙,方程式为3Ca(OH)2+3Br2+2NH3═3CaBr2+N2↑+6H2O;温度过高,Br2、NH3易挥发,反应中Br2、NH3的系数比是3:2,投料时控制n(Br2);n(NH3)=1:0.8,氨气过量,确保Br2被充分还原。
(5)产品是溴化钙,为提高产品纯度步骤⑧酸化时应加入的酸是氢溴酸。
(6) 取样品ɑ g,加水溶解滴入足量Na2CO3溶液充分反应后过滤,洗涤、干燥、冷却,称量,得到b g碳酸钙,根据钙元素守恒,样品的纯度为![]() ×100%。
×100%。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】某烷烃相对分子质量为86,如果分子中含有3个—CH3、2个—CH2—和1个![]() ,则该结构的烃的一氯取代物最多可能有几种(不考虑立体异构)
,则该结构的烃的一氯取代物最多可能有几种(不考虑立体异构)
A. 9种 B. 6种 C. 5种 D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L1NaOH溶液500 mL。根据溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________________。

(2)配制时,其正确的操作顺序是__________(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(3)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;
④使用之前要检查是否漏水。这些叙述中正确的是__________(填字母)。
A.①②③④ B.②③ C.①②④ D.②③④
(4)根据计算用托盘天平称取的NaOH固体质量为______g。
(5)下面操作造成所配NaOH溶液浓度偏高的是______(填字母)。
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列运用与碳酸钠或碳酸氢钠能发生水解的事实无关的是
A. 实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞
B. 泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将其混合就可产生大量二氧化碳的泡沫
C. 厨房中常用碳酸钠溶液洗涤餐具上的油污
D. 可用碳酸钠与醋酸制取少量二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算填空:
(1)3.01×1023个CO2分子中含_______ mol氧原子,在标准状况下其体积为_________L,
它与________g H2O含有相同的氧原子数。
(2)已知某盐酸的密度为1.2 g·mL-1,,该盐酸中HCl的质量分数为36.5%,用此盐酸配制480mL 2mol/L的稀盐酸,需取用________ mL该盐酸
(3)同温同压下,等质量的N2和CO2所含分子数比为________,体积比为________。
(4)某气体在标准状况下的密度为1.25g/L,则 28g该气体所含有的分子数为________。
(5)在标准状况下44.8 L某气体,其质量为60g,则其摩尔质量为_____。
(6)同温同压下,同体积的H2和A气体的质量分别为1.0g和16.0g,则A的相对分子质量为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com