
【题目】计算填空:
(1)3.01×1023个CO2分子中含_______ mol氧原子,在标准状况下其体积为_________L,
它与________g H2O含有相同的氧原子数。
(2)已知某盐酸的密度为1.2 g·mL-1,,该盐酸中HCl的质量分数为36.5%,用此盐酸配制480mL 2mol/L的稀盐酸,需取用________ mL该盐酸
(3)同温同压下,等质量的N2和CO2所含分子数比为________,体积比为________。
(4)某气体在标准状况下的密度为1.25g/L,则 28g该气体所含有的分子数为________。
(5)在标准状况下44.8 L某气体,其质量为60g,则其摩尔质量为_____。
(6)同温同压下,同体积的H2和A气体的质量分别为1.0g和16.0g,则A的相对分子质量为_____________。
【答案】 1 11.2 18 83.3 11:7 11:7 6.02×1023( 或NA ) 30g/mol 32
【解析】(1)3.01×1023个CO2分子的物质的量是3.01×1023÷6.02×1023/mol=0.5mol,其中含0.5 mol×2=1mol氧原子,在标准状况下其体积为0.5mol×22.4L/mol=11.2L。含有1mol氧原子的水是1mol,水的质量是18g H2O。(2)根据![]() 可知该浓盐酸的浓度是
可知该浓盐酸的浓度是![]() =12.0mol/L。由于没有480mL的容量瓶,需要配制500mL,则需要量取浓盐酸的体积是
=12.0mol/L。由于没有480mL的容量瓶,需要配制500mL,则需要量取浓盐酸的体积是![]() ;(3)同温同压下,等质量的N2和CO2所含分子数比为即为物质的量之比,为
;(3)同温同压下,等质量的N2和CO2所含分子数比为即为物质的量之比,为![]() ,体积比等于物质的量之比,为11:7;(4)某气体在标准状况下的密度为1.25g/L,则该气体的相对分子质量是1.25×22.4=28,所以28g该气体的物质的量是1mol,所含有的分子数为6.02×1023。(5)在标准状况下44.8 L某气体的物质的量是44.8L÷22.4L/mol=2mol,其质量为60g,则其摩尔质量为60g÷2mol=30g/mol。(6)同温同压下,同体积的H2和A气体的质量分别为1.0g和16.0g,则根据阿伏加德罗定律可知A的物质的量与氢气的物质的量相等,为1.0g÷2g/mol=0.5mol,所以A的相对分子质量为16.0÷0.5=32。
,体积比等于物质的量之比,为11:7;(4)某气体在标准状况下的密度为1.25g/L,则该气体的相对分子质量是1.25×22.4=28,所以28g该气体的物质的量是1mol,所含有的分子数为6.02×1023。(5)在标准状况下44.8 L某气体的物质的量是44.8L÷22.4L/mol=2mol,其质量为60g,则其摩尔质量为60g÷2mol=30g/mol。(6)同温同压下,同体积的H2和A气体的质量分别为1.0g和16.0g,则根据阿伏加德罗定律可知A的物质的量与氢气的物质的量相等,为1.0g÷2g/mol=0.5mol,所以A的相对分子质量为16.0÷0.5=32。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】异戊酸薄荷酯( )是一种治疗心脏病的药物,制备异戊酸薄荷酯P的流程如下:
)是一种治疗心脏病的药物,制备异戊酸薄荷酯P的流程如下:

已知: ;
;
![]()
完成下列问题:
(1)A的化学名称为____。试剂1的结构简式为____。
(2)由E生成F的化学方程式为____。
(3)试剂2可以是____试剂(填名称或化学式);该反应类型是 ____。
(4)由C和H生成P的化学方程式为____。
(5)M有多种同分异构体,写出所有满足下列条件的同分异构体的结构简式:____。
①属于酚类 ②能发生银镜反应
③核磁共振氢谱有4种峰、且峰值比为1:2:2:1
(6)苯乙烯是一种重要的化工原料。参考制备异戊酸薄荷酯中的方法,设计以苯、乙烯为有机原料(无机试剂自选),制备苯乙烯的合成线路:___。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙易溶于水,医学上可用于治疗神经衰弱、癫痫等症。
请回答下列问题:
Ⅰ.工业上溴的制备。
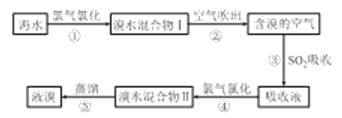
(1)步骤③中主要反应的化学方程式为___________________。
(2)不能直接用“溴水混合物I ”进行蒸馏得到液溴,原因是_________________。
Ⅱ.实验室溴化钙的制备。

(3)“合成”步骤中,所需装置最合适的是_____________(填选项字母)。

(4)“合成”步骤中的反应方程式为__________,“合成”步骤中需控制温度不能过高,原因是______________________,投料时控制n(Br2);n(NH3)=1:0.8,其目的是________________。
(5)步骤⑧酸化时应加入的酸是_________________。
(6)设计实验测定产品(主要成分CaBr2)纯度(不必描述操作过程的细节,物理量的数值可用字母表示):
______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G为前四周期中的常见元素,且原子序数依次增大,A的原子半径最小;B的基态原子L层电子数是K层电子数的2倍;C的基态原子最外层电子排布式为nsmnpm+2;D、E、F、G是位于同一周期的金属元素,元素D的焰色反应要透过蓝色钴玻璃才能观察到紫色,且D、G的原子序数相差10,E元素有多种化合价。它的一种氢氧化物在空气中易被氧化且最终变为红褐色,且E.、F的电子数相差1。
请回答下列问题:
(1)基态E原子的价电子排布式为_________________。
(2)与BC分子互为等电子体的离子为______________________(填化学式)。
(3)在B5A5、BC2中,B原子采取的杂化方式分別为____________、_____________。
(4)单质C有两种同素异形体,其中沸点高的是__________(填分子式),而它的简单氢化物的沸点比同主族的简单氢化物都高的原因是___________________。
(5)F可形成分子式均为F(NH3)5BrSO4的两种配合物,其中一种化学式为[F(NH3)5Br]SO4。向其溶液中加BaCl2溶液时,现象为_____________;向另一种配合物的溶液中加入BaCl2溶液时,无明显现象。若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为__________________。
(6)金属D、G晶体的晶胞结构如图所示。


①其中表示金属D晶体晶胞的结构图为__________(填“I”或“II”)。
②金属G的晶胞中,测得晶胞边长为361 pm,G 原子的半径约为_________pm(保留三位有效数字),D、G两种晶胞中金属的配位数之比为_______________。
③金属G、锌两种元素的笫一电离能、第二电离能如下表所示:
电离能/kJ mol-1 | I1 | I2 |
G | 746 | 1958 |
锌 | 906 | 1733 |
G的第二电离能(I2)大于锌的第二电离能,其主要原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素各项性质比较错误的是( )
A.半径:F->Na+>Mg2+>Al3+B.最高正价:O>N>C
C.电负性:O>C>SiD.酸性:HClO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BHT是一种常用的食品抗氧化剂,从![]() 出发合成BHT的方法有如下两种。下列说法错误的是
出发合成BHT的方法有如下两种。下列说法错误的是

A. 方法一的反应类型是加成反应
B. BHT与H3C![]() 都能使酸性KMnO4溶液褪色
都能使酸性KMnO4溶液褪色
C. 推测BHT在水中的溶解度小于苯酚
D. 从原子经济角度分析方法二优于方法一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的关系描述正确的是
A. 35Cl与37Cl属同素异形体 B. 12C、13C、14C是同种核素
C. O2与O3属同位素 D. H2O与D2O化学性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种锂钒氧化物热电池装置,电池总反应为xLi + LiV3O8===Li1+xV3O8。工作时,需先引发铁和氯酸钾反应使共晶盐融化。已知:LiCl-KCl共晶盐熔点为352 ℃。下列说法正确的是( )

A. 整个过程的能量转化只涉及化学能转化为电能
B. 放电时正极反应为Li1+xV3O8- xe-===LiV3O8+ xLi+
C. 放电时Cl-移向LiV3O8电极
D. Li-Si合金熔点高于352 ℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com