
【题目】已知A、B、C、D、E、F、G为前四周期中的常见元素,且原子序数依次增大,A的原子半径最小;B的基态原子L层电子数是K层电子数的2倍;C的基态原子最外层电子排布式为nsmnpm+2;D、E、F、G是位于同一周期的金属元素,元素D的焰色反应要透过蓝色钴玻璃才能观察到紫色,且D、G的原子序数相差10,E元素有多种化合价。它的一种氢氧化物在空气中易被氧化且最终变为红褐色,且E.、F的电子数相差1。
请回答下列问题:
(1)基态E原子的价电子排布式为_________________。
(2)与BC分子互为等电子体的离子为______________________(填化学式)。
(3)在B5A5、BC2中,B原子采取的杂化方式分別为____________、_____________。
(4)单质C有两种同素异形体,其中沸点高的是__________(填分子式),而它的简单氢化物的沸点比同主族的简单氢化物都高的原因是___________________。
(5)F可形成分子式均为F(NH3)5BrSO4的两种配合物,其中一种化学式为[F(NH3)5Br]SO4。向其溶液中加BaCl2溶液时,现象为_____________;向另一种配合物的溶液中加入BaCl2溶液时,无明显现象。若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为__________________。
(6)金属D、G晶体的晶胞结构如图所示。


①其中表示金属D晶体晶胞的结构图为__________(填“I”或“II”)。
②金属G的晶胞中,测得晶胞边长为361 pm,G 原子的半径约为_________pm(保留三位有效数字),D、G两种晶胞中金属的配位数之比为_______________。
③金属G、锌两种元素的笫一电离能、第二电离能如下表所示:
电离能/kJ mol-1 | I1 | I2 |
G | 746 | 1958 |
锌 | 906 | 1733 |
G的第二电离能(I2)大于锌的第二电离能,其主要原因是______________。
【答案】 3d44s2 CN-(或NO+或![]() C
C![]() ) sp2 sp O3 水分子间存在氢键 产生白色沉淀 [Co(NH8)6SO4]Br I 128 2:3 锌的价电子是3d104s2,而铜的是3d104s1,在失去一个电子后,铜失去的第二个电子在3d的全满轨道上,而锌的第二个电子在4s的半满轨道上,3d全满比4s半满能量低,结构也更稳定,所以需要更多能量
) sp2 sp O3 水分子间存在氢键 产生白色沉淀 [Co(NH8)6SO4]Br I 128 2:3 锌的价电子是3d104s2,而铜的是3d104s1,在失去一个电子后,铜失去的第二个电子在3d的全满轨道上,而锌的第二个电子在4s的半满轨道上,3d全满比4s半满能量低,结构也更稳定,所以需要更多能量
【解析】试题分析:A的原子半径最小,A是H元素;B的基态原子L层电子数是K层电子数的2倍,B是碳元素;C的基态原子最外层电子排布式为nsmnpm+2,n=2,则C是O元素;D、E、F、G是位于同一周期的金属元素,元素D的焰色反应要透过蓝色钴玻璃才能观察到紫色,D是K元素;且D、G的原子序数相差10,G是Cu元素;E的一种氢氧化物在空气中易被氧化且最终变为红褐色,E是Fe元素; E.、F的电子数相差1,F是Co元素。
解析:根据以上分析,(1)基态26号元素Fe的价电子排布式为3d64s2。
(2)与CO分子互为等电子体的离子为CN-。
(3)在C5H5、CO2直线结构,C原子采取的杂化方式分別为SP2、SP。
(4)单质O有两种同素异形体O2、O3,O3比O2相对分子质量大所以沸点高,水分子间形成氢键,所以沸点比同主族的简单氢化物都高。
(5) Co可形成分子式均为Co (NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,硫酸根离子在外界,溶于水能电离出硫酸根离子,所以向其溶液中加BaCl2溶液时,现象为生成白色沉淀;向另一种配合物的溶液中加入BaCl2溶液时,无明显现象。若加入AgNO3溶液时,产生淡黄色沉淀,说明硫酸根在内界,溴离子在外界,则第二种配合物的化学式为[Co(NH8)6SO4]Br。
(6)金属D、G晶体的晶胞结构如图所示。
①金属K是体心立方最密堆积,晶体晶胞的结构图为I。
②金属Cu的晶胞为面心立方,测得晶胞边长为361 pm,面对角线的为![]() ,G 原子的半径约为
,G 原子的半径约为![]() 128pm,金属K的配位数是8、计算Cu的配位数是12,配位数比是2:3。
128pm,金属K的配位数是8、计算Cu的配位数是12,配位数比是2:3。
③锌的价电子是3d104s2,而铜的是3d104s1,在失去一个电子后,铜失去的第二个电子在3d的全满轨道上,而锌的第二个电子在4s的半满轨道上,3d全满比4s半满能量低,结构也更稳定,所以需要更多能量所以Cu的第二电离能(I2)大于锌的第二电离能。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:
【题目】氯酸钾在工业上具有广泛的应用,某研究性学习小组利用如图所示的实验装置制备氯酸钾。回答下列问题:
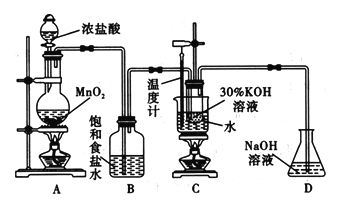
(1)写出装置C中发生反应的离子方程式:_______________________。
(2)若无B装置,则装置C中氯酸钾的产率将___________ (填“提高” “降低”或“无影响”)。
(3)在不同条件下KC1O3可将KI氧化为I2或KIO3。该小组设计了系列实验研究体系中硫酸浓度对反应产物的影响,实验的记录表如下表(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0. 20mol L-1KI/mL | V1 | 1.0 | 1.0 | 1.0 |
KC1O3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0mol L-1H2SO4/mL | 0 | 3.0 | V2 | 9.0 |
蒸馏水 | 9.0 | V3 | 3.0 | 0 |
实验现象 |
①实验设计表中V1=____________; V2 =_____________; V3 =_______________。
②设计1号试管实验的作用是_________________。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为__________________。
(4)工业上可用KC1O3与Na2SO3在H2SO4存在下制备高效、低毒的消毒剂C1O2,该反应的化学方程式为______________________ ;利用该反应原理,若工业上使用122.5吨KClO3与足量的Na2SO3反应,生成的ClO2用于除去工业废水中的Mn2+,可得到MnO2固体165吨,则该反应的产率约为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某品牌的家用消毒剂其有效成分为对氯间二甲苯酚(结构简式如下图所示),可以杀灭常见的病毒与细菌。下面有关该物质的说法正确的是

A. 该物质的分子式是C8H10ClO
B. 1mol该物质最多可以与2mol NaOH反应
C. 1mol该物质可以与2mol液溴发生取代反应
D. 该物质可以发生加成、取代、消去、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列运用与碳酸钠或碳酸氢钠能发生水解的事实无关的是
A. 实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞
B. 泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将其混合就可产生大量二氧化碳的泡沫
C. 厨房中常用碳酸钠溶液洗涤餐具上的油污
D. 可用碳酸钠与醋酸制取少量二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于二氧化硫的说法中,不正确的是( )
A.使某些有机色质褪色 B.无色,有刺激性气味,无毒
C.既有氧化性,又有还原性 D.既可溶于水,又可与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算填空:
(1)3.01×1023个CO2分子中含_______ mol氧原子,在标准状况下其体积为_________L,
它与________g H2O含有相同的氧原子数。
(2)已知某盐酸的密度为1.2 g·mL-1,,该盐酸中HCl的质量分数为36.5%,用此盐酸配制480mL 2mol/L的稀盐酸,需取用________ mL该盐酸
(3)同温同压下,等质量的N2和CO2所含分子数比为________,体积比为________。
(4)某气体在标准状况下的密度为1.25g/L,则 28g该气体所含有的分子数为________。
(5)在标准状况下44.8 L某气体,其质量为60g,则其摩尔质量为_____。
(6)同温同压下,同体积的H2和A气体的质量分别为1.0g和16.0g,则A的相对分子质量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:Ⅰ.RCOOR′+R″18OH![]() RCO18OR″+R′OH(R、R′、R″代表烃基)
RCO18OR″+R′OH(R、R′、R″代表烃基)
Ⅱ.
![]()
 (R、R′代表烃基)
(R、R′代表烃基)
(1)①的反应类型是________。
(2)②的化学方程式为____________________________________。
(3)PMMA单体的官能团名称是______________________________、__________________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为___________。
(5)G的结构简式为__________________________________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d.1 mol  与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是________________________________________。
(8)写出由PET单体制备PET聚酯并生成B的化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向紫色石蕊试液中加入过量Na2O2 粉末,振荡,可观察到的现象为
A. 溶液最终变为红色 B. 溶液最终变为蓝色
C. 有气泡产生,溶液先变蓝色后变为无色 D. 有气泡产生,溶液仍为紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是合成降血脂药物阿伐他汀的重要中间体,其合成路线如下:

(1)化合物D中的含氧官能团为酰胺键、_____________和_____________(填官能团名称)。
(2)反应①→⑤中,属于取代反应的是_____________(填序号)。
(3)此合成路线中F的产率不高,原因是反应①中还有一种和B互为同分异构体的副产物生成,其结构简式为_____________。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:_____________。
I.分子中含有一个含氧5元环;II.可使溴水褪色;
III.核磁共振氢谱显示氢原子的峰值比为1︰1︰2︰3。
(5)请以CH3COOC2H5和HCHO为原料制备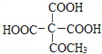 ,写出相应的合成路线流程图________(无机试剂任用,合成路线流程图示例见本题题干)。
,写出相应的合成路线流程图________(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com