
【题目】下列哪种说法可以证明反应N2+3H2![]() 2NH3已达到平衡状态( )
2NH3已达到平衡状态( )
A.1个N≡N键断裂的同时,有3个H—N键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键断裂的同时,有6个H—N键断裂
D.1个N≡N键断裂的同时,有6个H—N键形成
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,只改变反应物中n(SO2)对反应2SO2(g)+O2(g)2SO3(g)的影响如图所示,下列说法正确的是( )
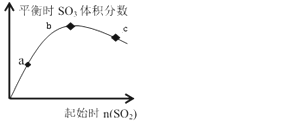
A. 反应a、b、c点均为平衡点,且b点时SO2的转化率最高
B. b点时SO2与O2 的物质的之比约为2:1
C. a、b、c 三点平衡常数: Kb>Kc>Ka
D. a、b、c 三点反应速率大小为: vb>vc>va
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含NaOH 20.0g的稀溶液与足量稀盐酸反应,放出28.7 kJ的热量,表示该反应的热化学方程式正确的是( )
A.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= +28.7 kJ·mol-1
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= _28.7 kJ·mol-1
C.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H=+57.4 kJ·mol-1
D.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= _57.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
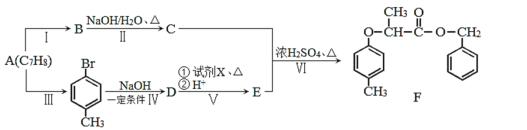
【题目】有机物F是一种香料,其合成路线如图所示:
已知:ⅰ.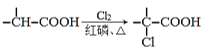
ⅱ.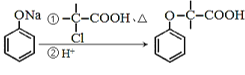
(1)D的名称为___,试剂X的结构简式为___,步骤Ⅵ的反应类型为___。
(2)步骤Ⅰ的反应试剂和条件分别为___、___。
(3)步骤Ⅱ反应的化学方程式为___。
(4)满足括号中条件(①苯环上只有两个取代基,②能与FeCl3溶液发生显色反应,③能发生水解反应和银镜反应)的E的同分异构体有___种,其中核磁共振氢谱峰面积比为6︰2︰2︰1︰1的分子的结构简式为___。
(5)依据题中信息,完成以![]() 为原料制取
为原料制取![]() 的合成路线图___。(无机试剂一定要选银氨溶液,其它无机试剂任选)
的合成路线图___。(无机试剂一定要选银氨溶液,其它无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化白藜芦醇W具有抗病毒等作用。下面是利用Heck反应合成W的一种方法:
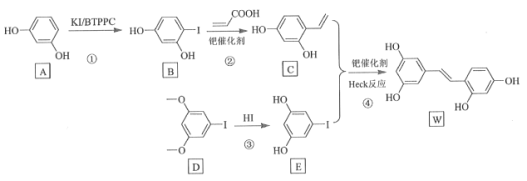
回答下列问题:
![]() 的化学名称为___________。
的化学名称为___________。
![]()
![]() 中的官能团名称是___________。
中的官能团名称是___________。
![]() 反应③的类型为___________,W的分子式为___________。
反应③的类型为___________,W的分子式为___________。
![]() 不同条件对反应④产率的影响见下表:
不同条件对反应④产率的影响见下表:
实验 | 碱 | 溶剂 | 催化剂 | 产率 |
1 | KOH | DMF |
|
|
2 |
| DMF |
|
|
3 |
| DMF |
|
|
4 | 六氢吡啶 | DMF |
|
|
5 | 六氢吡啶 | DMA |
|
|
6 | 六氢吡啶 | NMP |
|
|
上述实验探究了________和________对反应产率的影响。此外,还可以进一步探究________等对反应产率的影响。
![]() 为D的同分异构体,写出满足如下条件的X的结构简式________________。
为D的同分异构体,写出满足如下条件的X的结构简式________________。
含有苯环;②有三种不同化学环境的氢,个数比为6:2:1;③1 mol的X与足量金属Na反应可生成2 g H2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知充分燃烧ag乙炔(C2H2)气体时生成1mol二氧化碳和液态水,并放出热量bkJ,则下列乙炔燃烧的热化学方程式书写正确的是( )
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-4bkJ·mol-1
B.C2H2(g)+![]() O2(g)=2CO2(g)+H2O(l) ΔH=2bkJ·mol-1
O2(g)=2CO2(g)+H2O(l) ΔH=2bkJ·mol-1
C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2bkJ·mol-1
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=4bkJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)5 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A. ①②④⑦⑧B. ③④⑤⑥⑦
C. ①④⑤⑥⑦⑧D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用H2O2和H2SO4的混合溶液可溶出印刷电路板中的铜,其热化学方程式为Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l) ΔH已知①Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1=+64 kJ·mol-1②2H2O2(l)===2H2O(l)+O2(g) ΔH2=-196 kJ·mol-1③H2(g)+1/2O2(g)===H2O(l) ΔH3=-286kJ·mol-1。下列说法不正确的是
A. 反应①可通过铜作电极电解稀H2SO4的方法实现
B. 反应②在任何条件下都能自发进行
C. 若H2(g)+1/2O2(g)===H2O(g) ΔH4,则ΔH4<ΔH3
D. ΔH=-320 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)单质钠是一种______色的金属,密度比水______![]() 大
大![]() 小
小![]() ,钠在自然界中以______
,钠在自然界中以______![]() 化合
化合![]() 游离
游离![]() 态存在;金属钠与水反应的化学方程式:______,金属钠在空气中燃烧生成______色的______
态存在;金属钠与水反应的化学方程式:______,金属钠在空气中燃烧生成______色的______![]() 化学式
化学式![]() ,其生成物与水反应的化学方程式:______。
,其生成物与水反应的化学方程式:______。
(2)氯气是一种______色的气体,密度比空气______,______溶于水,并可以和水发生反应,写出其反应的化学方程式:______,实验室中用______溶液![]() 化学式
化学式![]() 吸收多余的氯气。
吸收多余的氯气。
铁丝在氯气中燃烧的化学方程式:______。漂白粉是______和______![]() 化学式
化学式![]() 的混合物,是利用氯气与氢氧化钙反应制成的,写出其反应的方程式:______。
的混合物,是利用氯气与氢氧化钙反应制成的,写出其反应的方程式:______。
(3)现有物质:①氧化镁②硫酸铜③碳酸钙④金属钠⑤氯气⑥氢气⑦硫酸⑧氯水⑨二氧化硫⑩氧化钠![]() 二氧化硅
二氧化硅![]() 次氯酸
次氯酸![]() 漂白粉
漂白粉
按下列标准进行归类![]() 填序号
填序号![]() 混合物______酸______盐______单质______碱性氧化物______酸性氧化物______。
混合物______酸______盐______单质______碱性氧化物______酸性氧化物______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com