
【题目】以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)5 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A. ①②④⑦⑧B. ③④⑤⑥⑦
C. ①④⑤⑥⑦⑧D. 全部
【答案】C
【解析】
在物质或离子中中心原子含有空轨道,和含有孤电子对的原子或离子能形成配位键,①氢离子提供空轨道,氮原子提供孤电子对;②无空轨道,无孤电子对;③无空轨道,④氢离子提供空轨道,氮原子提供孤电子对;⑤铁原子提供空轨道,碳原子提供孤电子对;⑥铁离子提供空轨道,硫原子提供孤电子对;⑦氢离子提供空轨道,氧原子提供孤电子对;⑧银离子提供空轨道,氮原子提供孤电子对;据此分析解答。
①氢离子提供空轨道,N2H4氮原子提供孤电子对,所以能形成配位键,N2H5+含有配位键,①选;
②甲烷中碳原子满足8电子稳定结构,氢原子满足2电子稳定结构,无空轨道,无孤电子对,CH4不含有配位键,②不选;
③OH-电子式为![]() ,无空轨道,OH-不含有配位键,③不选;
,无空轨道,OH-不含有配位键,③不选;
④氨气分子中氮原子含有孤电子对,氢离子提供空轨道,可以形成配位键,NH4+含有配位键,④选;
⑤Fe原子有空轨道,CO中的碳原子上的孤电子对,可以形成配位键,Fe(CO)5含有配位键,⑤选;
⑥SCN-的电子式![]() ,铁离子提供空轨道,硫原子提供孤电子对,Fe(SCN)3含有配位键,⑥选;
,铁离子提供空轨道,硫原子提供孤电子对,Fe(SCN)3含有配位键,⑥选;
⑦H3O+中O提供孤电子对,H+提供空轨道,二者形成配位键,H3O+含有配位键,⑦选;
⑧Ag+有空轨道,NH3中的氮原子上的孤电子对,可以形成配位键,Ag(NH3)2OH含有配位键,⑧选;
综上,①④⑤⑥⑦⑧微粒中含有配位键,C项正确,
答案选C。


科目:高中化学 来源: 题型:
【题目】用2个Cl取代甲醛分子中的H可得到碳酰氯,下列描述正确的是
A. 碳酰氯分子为平面三角形,分子中存在一个π键
B. 碳酰氯分子中的C原子为sp3杂化
C. 甲醛分子中的H-C-H键角与碳酰氯分子中的Cl-C-Cl相等
D. 甲醛分子中有4个σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种物质,它们的相互转化关系如下图(反应条件略,有些反应的产物和反应的条件没有全部标出)。已知A、B、E是单质,其中A着火只能用干燥的沙土灭火,B在常温下为气体,C俗名称为烧碱,D为无色无味液体。

(1)写出A、B、F的化学式 A______ B ______ F ______。
(2)写出A和D反应生成B和C的化学方程式_____________。若生成3mol的B,则转移的电子数目为_______________ 。
(3)写出E与C、D反应生成的B和F离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在一个密闭容器中进行的反应C(s)+H2O(g) ![]() CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
①增加C的量; ②增加CO的量;
③将容器的体积缩小一半; ④保持体积不变,充入N2以增大压强;
⑤升高反应体系的温度; ⑥保持压强不变,充入N2以增大体积。
A. ②③ B. ①④ C. ①⑥ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某碳酸氢钠样品的纯度,取21g含有杂质的碳酸氢钠样品投入到100mL未知浓度的盐酸中,两者恰好完全反应(杂质不反应),生成二氧化碳气体4.48L(标准状况)。
(1)该碳酸氢钠样品中碳酸氢钠的纯度________________。
(2)盐酸的物质的量浓度______________________。
要求:写出相关方程式及详细计算公式和步骤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出砷的元素符号____________,原子中所有电子占有______个轨道,核外共有________个不同运动状态的电子。
(2)写出Ni的元素名称________,该元素在周期表的位置为第____周期,第____族。
(3)第四周期基态原子中未成对电子数最多的元素是_________,该元素基态原子的价电子轨道表示式为________________。
(4)第三电子层上有____个能级,作为内层最多可容纳___个电子,作为最外层时,最多可含有__个未成对电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将质量比为4:5的SO2和SO3混合,则混合气体中SO2和SO3的物质的量之比为__,硫原子和氧原子个数之比为___。
(2)将5mol/L盐酸10mL稀释到200mL,稀释后溶液的物质的量浓度是__。
(3)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__。
(4)已知15.6gNa2X固体中含有0.4molNa+。请计算:
a.X的相对原子质量为__。
b.将39gNa2X固体溶解到水中,并加水稀释至2L,则所得溶液中Na+的物质的量浓度为___mol/L。
(5)质量都是10g的HCl、NH3、CO2、H2四种气体在标准状况下,体积最小的是__;密度最小的是__。(填化学式)
(6)漂白粉是用Cl2与___(填化学式)反应来制取的,漂白粉是___(填“混合物”或“纯净物”),其有效成分为__(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A. 常温常压下, 30 g乙烷中所含的极性共价键数为6NA
B. 0.2mol N2和0.6mol H2混合充分反应后,转移的电子数目为1.2 NA
C. 0.1 mol9038Sr原子中含中子数为3.8NA
D. 1L1 mol·L-1 Ca(ClO)2溶液中含ClO-的数目等于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用双离子交换膜电解法可以处理含NH4NO3的工业废水,原理如图所示,下列叙述错误的是
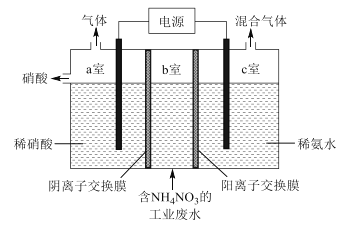
A. NH4+由b室向c室迁移
B. c室得到的混合气体是NH3和H2
C. 阳极反应式为2H2O -4e-=O2+4H+
D. 理论上外电路中流过1mol电子,可处理工业废水中0.5mol NH4NO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com