
【题目】(1)写出砷的元素符号____________,原子中所有电子占有______个轨道,核外共有________个不同运动状态的电子。
(2)写出Ni的元素名称________,该元素在周期表的位置为第____周期,第____族。
(3)第四周期基态原子中未成对电子数最多的元素是_________,该元素基态原子的价电子轨道表示式为________________。
(4)第三电子层上有____个能级,作为内层最多可容纳___个电子,作为最外层时,最多可含有__个未成对电子。
【答案】(11分,每空1分) (1)As 18 33 (2)镍 4 Ⅷ
(3)铬或Cr![]() (4)3 18 3
(4)3 18 3
3d 4s
【解析】
试题(1)砷的元素符号为As,是第33号元素,核外有33个不同运动状态的电子,其核外电子排布为:1S22S22P63S23P64S23d104S24P3,即有18个轨道,故答案为:As;18;33;
(2)镍的元素符号位Ni,在周期表中的第4周期,第Ⅷ族,故答案为:镍;4;Ⅷ;
(3)第四周期元素中,外围电子排布为ndxnsy,且能级处于半满稳定状态时,含有的未成对电子数最多,即外围电子排布为3d54s1,此元素为铬,其基态原子的价电子轨道表示为![]() ,故答案为:铬;
,故答案为:铬;![]() ;
;
(4)第三电子层上有S、P、d三个不同的能级,由于每个电子层最多容纳2n2个电子,故当第三层作为内层时,最多可容纳18个电子,作为最外层时,当3P轨道仅填充3电子时未成对电子最多,有3个未成对电子,故答案为:3;18;3


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成都需要用它。
(1)工业上通常采用电解法制氯气,请观察图后回答下列问题:

① 请写出该反应的化学方程式________________________________。
② 通电后,b侧产生的气体是______![]() 填化学式
填化学式![]() 。
。
(2)某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉![]() 这是一个放热反应
这是一个放热反应![]() ,回答下列问题:
,回答下列问题:

①在A装置中用固体二氧化锰与浓盐酸,在加热条件下制取氯气,请写出反应的化学方程式________________________________。
②漂白粉将在U形管中产生,其化学方程式是______________________________。
③装置C的作用是______________。
④此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
I.温度较高时氯气与消石灰反应生成![]() ,为避免此副反应的发生,可采取的措施是________________________。
,为避免此副反应的发生,可采取的措施是________________________。
II.试判断另一个副反应![]() 用化学方程式表示
用化学方程式表示![]() ______________________________,为避免此副反应的发生,可以在A与B之间连接一个装有______的洗气瓶。
______________________________,为避免此副反应的发生,可以在A与B之间连接一个装有______的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】这次中美贸易战的矛盾激化,也让我们看到了中国半导体产业存在的诸多不足,俗话说“亡羊补牢,为时未晚”,找出存在的不足,然后针对地去解决问题,才能让半导体产业链发展壮大起来。三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂及光导纤维原料。一研究小组在实验室模拟反应![]() 制备POCl3并测定产品含量。
制备POCl3并测定产品含量。
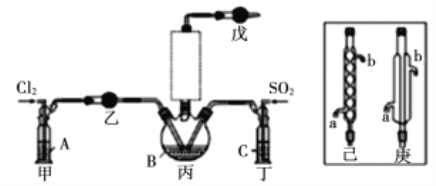
资料卡片:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -93.6 | 76.1 | 137.5 | 遇水剧烈水解,易与O2反应 |
POCl3 | 1.25 | 105.8 | 153.5 | 遇水剧烈水解,能溶于PCl3 |
SOCl2 | -105 | 78.8 | 119 | 遇水剧烈水解,受热易分解 |
(1)若选用Na2SO3固体与70%浓H2SO4制取SO2,反应的离子方程式是:______________。
(2)溶液A为饱和食盐水,乙装置中应该盛装的试剂为__________(填“P2O5”或“碱石灰”或“浓H2SO4”或“无水硫酸铜”);反应装置图的虚框中未画出的仪器最好选择______(填“己”或“庚”)。
(3)甲、丁装置的作用除了用于气体的净化除杂外,还有_____________________________。
(4)水浴加热三颈烧瓶,控制反应温度在60~65℃,其原因是_________________________。
(5)产品经提纯后仍含少量PCl3杂质,通过佛尔哈德法可测定产品中POCl3的含量:准确称取1.500g样品在碘量瓶中摇动至完全水解,将水解液配成100 mL溶液,取10.00 mL于锥形瓶中,加入0.2000 mol·L-1的AgNO3溶液20.00mL(Ag++C1-=AgC1↓),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入NH4Fe(SO4)2作指示剂,用0.1000mol·L-1KSCN标准溶液滴定过量的AgNO3至终点(Ag++SCN-=AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00mL。
①达到滴定终点的现象是_____________________________________________________。
②POCl3的质量分数为________________________。
③已知:KSP(AgC1)=3.2×10-10 mol2·L-2,KSP(AgSCN)=2×10-12 mol2·L-2,若无硝基苯覆盖沉淀表面,测定POCl3的质量分数将___________(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式错误的是( )
A. Na+的轨道表示式: 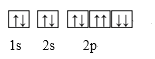
B. Na+的结构示意图:![]()
C. Na的电子排布式:1s22s22p63s1
D. Na的简化电子排布式:[Ne]3s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)5 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A. ①②④⑦⑧B. ③④⑤⑥⑦
C. ①④⑤⑥⑦⑧D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等
B. 1 mol Na与O2反应,生成Na2O和Na2O2的混合物共失去NA个电子
C. 1mol Na2O2固体中含有离子总数为4NA
D. 25℃时,pH=13的氢氧化钠溶液中约含有NA个氢氧根离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100nL,Va、Vb与混合液的p的关系如图所示。下列说法正确的是

A. Ka(HA)=Kb(BOH)=1×10-6B. b点时,c(A-)=c(B+)=c(H+)=c(OH-)
C. c点时,c(A-)>c(B+)D. a→c过程中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此,下列说法正确的是( )
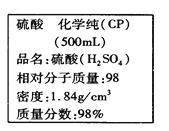
A. 该硫酸的物质的量浓度为9.2 mol·L-1
B. 该硫酸与等体积的水混合所得溶液的质量分数小于49%
C. 配制250mL 4.6 mol·L-1的稀硫酸需取该硫酸62.5mL
D. 该硫酸50.0mL与足量的铜反应可得到标准状况下SO2气体10.304 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的化工原料,可用于合成工业的催化剂和氧化剂。采用软锰矿(主要成分为MnO2)可制备高纯MnO2,其流程如下:

下列叙述错误的是
A. “含Mn2+、A13+的溶液”中还含Fe3+
B. 加入“氨水”同时搅拌,搅拌的目的是提高反应速率
C. “滤渣”可完全溶解在NaOH溶液中
D. 电解含Mn2+的溶液,MnO2为阳极产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com