
【题目】为测定某碳酸氢钠样品的纯度,取21g含有杂质的碳酸氢钠样品投入到100mL未知浓度的盐酸中,两者恰好完全反应(杂质不反应),生成二氧化碳气体4.48L(标准状况)。
(1)该碳酸氢钠样品中碳酸氢钠的纯度________________。
(2)盐酸的物质的量浓度______________________。
要求:写出相关方程式及详细计算公式和步骤。
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,进行了如下探究。
检验溶液中的阴、阳离子:取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成。再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是____和_____;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是_____。
测定碳铵中C元素和N元素质量比。该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图1所示。

(3)碳铵固体应放在____中进行加热。
A.试管 B.蒸发皿 C.烧瓶 D.坩埚
(4)从安全的角度考虑,尾气处理的装置可以选用如图2_____;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg。由此测得N元素的质量是____g。
(6)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量。请你评价该方案是否合理;_____(填“合理”“不合理”),理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如图所示,下列分析合理的是

A. 催化剂a表面发生了极性共价键的断裂和形成
B. 在催化剂b表面形成氮氧键时,不涉及电子转移
C. N2与H2反应生成NH3的原子利用率为100%
D. 催化剂a、b能提高反应的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。

(1)向A、B溶液中分别滴入几滴KSCN溶液, A溶液颜色:________B溶液颜色_______。
(2)写出上述过程中有关反应的离子方程式:A→B___________________。若有2mol的A参与该反应,则转移______mol电子。A作_____剂
(3)B→C(暴露在空气中)可看到的现象是__________________________________。
(4)将A的饱和溶液制成胶体的操作______________________;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为___________效应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝土矿主要含Al2O3。某课题组以此为原料回收氧化铝,设计实验流程如下:
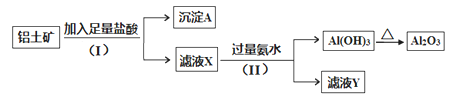
(1)步骤(I)中分离溶液和沉淀的操作名称是______,实验中除了烧杯和玻璃棒外,还需要用到的玻璃仪器是______________。
(2)写出步骤(Ⅱ)中生成Al(OH)3的离子方程式_______________________________。
(3)实验室里用NaAlO2 溶液制取Al(OH)3最好选用________(填序号)。
A.NaOH溶液 B.稀硫酸 C.二氧化碳
(4)取54g铝土矿进行实验,最后得到氧化铝51g,则该铝土矿中铝的含量为______(假设实验过程没有损失)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH- ④NH4+ ⑤Fe(CO)5 ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A. ①②④⑦⑧B. ③④⑤⑥⑦
C. ①④⑤⑥⑦⑧D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是CH4)为原料经合成气(主要成分为CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:_____________________。
(2)与CO互为等电子体的分子和离子分别为________和________(各举一种即可,填化学式),CO分子的电子式为________,CO分子的结构式可表示成________。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有___,CH3OH的熔、沸点比CH4高,其主要原因是__________。
(4)CH3CHO分子中,—CH3中的碳原子采取________杂化方式,—CHO中的碳原子采取________杂化方式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,中间有一可自由滑动的隔板,将容器分成两部分。当左边充入28克N2,右边充入8克CO和CO2的混合气体时,隔板处于如图所示位置(两侧温度相同)。下列说法正确的是

A.右边CO和CO2的分子数之比为1∶3
B.右边CO的质量为2.75克
C.若改变右边CO和CO2的充入量而使隔板处于距离右端1/6处,保持温度不变,则前后两次充入密闭容器内的气体总压强之比为25∶24
D.右侧气体密度是相同条件下氢气密度的32倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.22.4L气体所含的分子数一定大于11.2L气体所含的分子数
B.常温常压下, 由O3与O2组成的混合气体48g含有的原子数为3NA
C.标准状况下,33.6L 四氯化碳(CCl4)中含有的碳原子数目为1.5NA
D.常温常压下,7.1 g Cl2与足量的Fe充分反应,转移的电子数目为0.3 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com