
【题目】随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是CH4)为原料经合成气(主要成分为CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:_____________________。
(2)与CO互为等电子体的分子和离子分别为________和________(各举一种即可,填化学式),CO分子的电子式为________,CO分子的结构式可表示成________。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有___,CH3OH的熔、沸点比CH4高,其主要原因是__________。
(4)CH3CHO分子中,—CH3中的碳原子采取________杂化方式,—CHO中的碳原子采取________杂化方式。
【答案】[Ar]3d64s2 N2; CN-; ![]() C≡O CH4、CH3OH CH3OH分子是极性分子,同时分子之间还存在着氢键的作用 sp3 sp2
C≡O CH4、CH3OH CH3OH分子是极性分子,同时分子之间还存在着氢键的作用 sp3 sp2
【解析】
(1)Fe的原子序数为26,利用电子排布规律来书写电子排布式;
(2)CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,则C、O之间为三键,等电子体中原子数和价电子数都相同;
(3)判断原子采取杂化方式时,先根据价层电子对互斥理论判断价层电子对,然后再确定采取的杂化方式;氢原子与电负性大、半径小的原子X(氟、氧、氮等)以共价键结合,若与电负性大的原子Y(与X相同的也可以)接近,在X与Y之间以氢为媒介,生成X-H…Y形式的一种特殊的分子间相互作用,称为氢键;
(4)判断原子采取杂化方式时,先根据价层电子对互斥理论判断价层电子对,然后再确定采取的杂化方式.
(1)Fe的原子序数为26,则基态电子排布式为[Ar]3d64s2,
故答案为:[Ar]3d64s2;
(2)等电子体中原子数和价电子数都相同,则N2、CN-、CO的原子数都是2,价电子数都是10,则互为等电子体,所以其中分子为:N2,离子为:CN-;互为等电子体的分子结构相似,根据氮气的结构式与电子式可知,CO分子结构式为C≡O,电子式为:![]() ,
,
故答案为:N2;CN-;![]() ;C≡O;
;C≡O;
(3)在CO分子中价层电子对数=σ键电子对数(1)+中心原子上的孤电子对数(1),所以碳原子采取sp杂化;在CH3OH中,价层电子对数=σ键电子对数(4)+中心原子上的孤电子对数(0),所以碳原子采取sp3杂化;CH4分子中价层电子对数=σ键电子对数(4)+中心原子上的孤电子对数(0),所以碳原子采取sp3杂化。CH3OH分子是极性分子,且CH3OH形成分子间氢键,沸点较CH4高,
故答案为:CH4、CH3OH;CH3OH分子是极性分子,同时分子之间还存在着氢键的作用;
(4)价层电子对数=σ键电子对数+中心原子上的孤电子对数,-CH3中价层电子对数=σ键电子对数(4)+中心原子上的孤电子对数(0)所以碳原子采用sp3;-CHO价层电子对数=σ键电子对数(3)+中心原子上的孤电子对数(0),所以碳原子采用sp3。
故答案为:sp3;sp2。


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知在常温下测得浓度均为0.1mol/L的下列 3 种溶液的 pH:
溶质 | NaHCO3 | Na2CO3 | NaClO |
pH | 8.34 | 11.6 | 10.3 |
下列有关说法正确的是( )
A. 以上溶液的 pH 是用广泛 pH 试纸测定的
B. 反应CO2+H2O+2NaClO=Na2CO3+2HClO可以发生
C. 室温下,电离常数: K2( H2CO3)>K( HClO)
D. 在新制氯水中加入少量 NaHCO3固体可以提高溶液中 HClO 的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,制取氯化锌晶体的工艺流程如下:
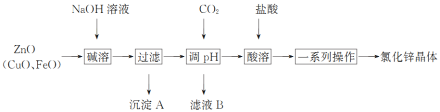
已知:Zn及其化合物的性质与Al及其化合物的性质相似,pH>11时,Zn(OH)2能溶于NaOH溶液生成ZnO22—。
(1)“调pH”步骤中通入过量CO2时发生反应的化学方程式为________;“酸溶”时发生反应的离子方程式为___________。
(2)下列说法不正确的是_______。
A 加入过量NaOH溶液的目的是提高锌元素的浸取率
B 沉淀A的主要成分是CuO、FeO
C 洗涤沉淀时,直接将洗涤剂加入漏斗,并用玻璃棒轻轻搅拌
D 利用结晶法可以从氯化锌溶液中获得氯化锌晶体
(3)流程中需进行蒸发浓缩,在实验室中进行蒸发浓缩的具体操作是_____。
(4)氯化锌晶体是白色晶体,可含1、1.5、2.5、3、4个结晶水,易潮解,易溶于水,溶于乙醇、丙酮。由氯化锌晶体制备无水氯化锌的装置如图,其中滴液漏斗中盛放的是SOCl2(SOCl2熔点为105 ℃、沸点为78.8 ℃、遇水剧烈水解生成两种酸性气体)。
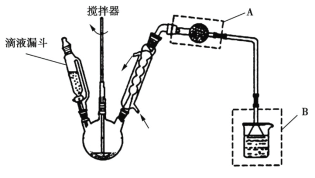
①下列物质中最适合洗涤氯化锌晶体的是_________。
A 冷水 B 浓盐酸 C 乙醇 D 氨水
②仪器A的名称为_______;装置B的作用是_________。
③以ZnCl2·H2O为例,写出三颈烧瓶中发生反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某碳酸氢钠样品的纯度,取21g含有杂质的碳酸氢钠样品投入到100mL未知浓度的盐酸中,两者恰好完全反应(杂质不反应),生成二氧化碳气体4.48L(标准状况)。
(1)该碳酸氢钠样品中碳酸氢钠的纯度________________。
(2)盐酸的物质的量浓度______________________。
要求:写出相关方程式及详细计算公式和步骤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
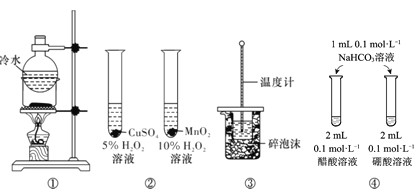
A.方案①用于分离I2和NH4Cl固体
B.方案用于比较CuSO4和MnO2的催化活性
C.方案③用于测定中和热
D.方案④用于比较醋酸和硼酸的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将质量比为4:5的SO2和SO3混合,则混合气体中SO2和SO3的物质的量之比为__,硫原子和氧原子个数之比为___。
(2)将5mol/L盐酸10mL稀释到200mL,稀释后溶液的物质的量浓度是__。
(3)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__。
(4)已知15.6gNa2X固体中含有0.4molNa+。请计算:
a.X的相对原子质量为__。
b.将39gNa2X固体溶解到水中,并加水稀释至2L,则所得溶液中Na+的物质的量浓度为___mol/L。
(5)质量都是10g的HCl、NH3、CO2、H2四种气体在标准状况下,体积最小的是__;密度最小的是__。(填化学式)
(6)漂白粉是用Cl2与___(填化学式)反应来制取的,漂白粉是___(填“混合物”或“纯净物”),其有效成分为__(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p2;②1s22s22p63s23p3;③1s22s22p4;④1s22s22p3。则下列有关比较中正确的是( )
A. 电负性:④>③>②>①
B. 原子半径:③>④>②>①
C. 第一电离能:④>③>②>①
D. 最高正化合价:③>④=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8.0 g铁粉加入到100 mL 2.0 mol/L FeCl3溶液中,发生反应为Fe+2Fe3+=3Fe2+,反应后过滤、洗涤、烘干得固体质量为m。下列说法不正确的是( )
A.m=2.4gB.Fe3+在反应中做氧化剂,失去0.2mol电子
C.该反应是化合反应D.反应后溶液中n(Fe2+)=0.3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素 CO(NH2)2,原理如图。下列有关说法正确的是
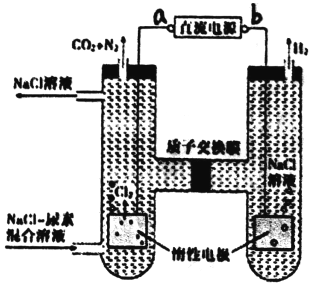
A. a为电源的负极
B. 电解前后,阴极室溶液的pH不变
C. 阳极室中发生的电极反应为2H++2e-=H2↑
D. 若两极共收集到气体产品13.44L,则除去的尿素为7.2g(忽略气体的溶解)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com