
【题目】下列实验方案中,能达到相应实验目的的是
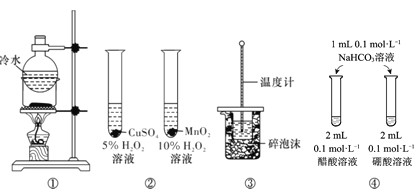
A.方案①用于分离I2和NH4Cl固体
B.方案用于比较CuSO4和MnO2的催化活性
C.方案③用于测定中和热
D.方案④用于比较醋酸和硼酸的酸性强弱
科目:高中化学 来源: 题型:
【题目】以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO、Al2O3和SiO2)为原料制备马日夫盐[Mn(H2PO4)2·2H2O(磷酸二氢锰)]的主要工艺流程如图:
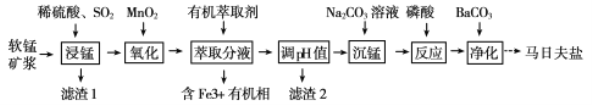
(1)用MnO2“氧化”时发生反应的离子方程式为__________________________________。
(2)如何检验“沉锰”己完成_____________________________________________________。
(3)铁离子的萃取率与接触时间和溶液的pH之间的关系如图1、2所示,则应选择的接触时间为_______;pH>1.7,铁离子的萃取率急剧下降的原因可能为____________________。
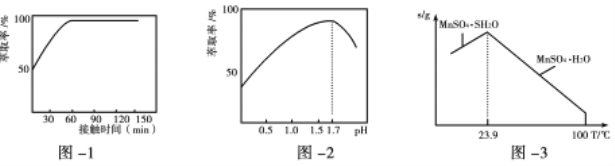
(4)结合图3的溶解度曲线,请补充完整由浸锰得到的溶液制备MnSO4·H2O的实验方案:边搅拌边向溶液中滴加适量的双氧水,再向滤液中加入MnCO3粉末调节溶液的pH范围为_________,过滤洗涤,将滤液与洗涤液合并,控制温度在80℃~90℃之间蒸发浓缩、______________,(填操作名称)得到MnSO4·H2O,用80℃~90℃的蒸馏水洗涤2~3次,放在真空干燥箱中低温干燥。[已知该溶液中pH=7.8时Mn(OH)2开始沉淀:pH=5.0时Fe(OH)3、Al(OH)3沉淀完全,pH=8.8时Fe(OH)2沉淀完全]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用印刷电路的废腐蚀液(含有大量CuCl2、FeCl2和FeCl3)回收Cu,主要流程如下:
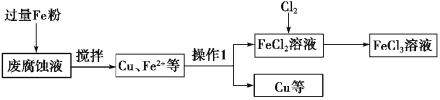
(1)操作1的名称是__________,需要用到的玻璃仪器有________________________。
(2)加入过量铁粉发生的离子反应有_______________。
(3)获得的铜粉中含有杂质,除杂所需的试剂是_______________(填化学式)。
(4)实验室利用如图所示装置制取一定量的FeCl3。
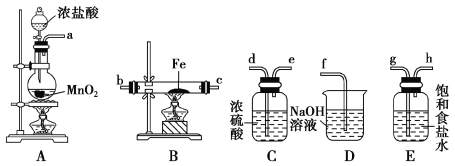
各装置的正确连接顺序为(填写装置代号)A→______→______→______→D。装置C的作用是____________________________,写出装置D中反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝土矿主要含Al2O3。某课题组以此为原料回收氧化铝,设计实验流程如下:
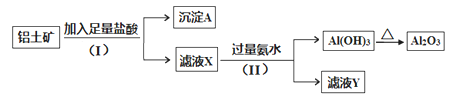
(1)步骤(I)中分离溶液和沉淀的操作名称是______,实验中除了烧杯和玻璃棒外,还需要用到的玻璃仪器是______________。
(2)写出步骤(Ⅱ)中生成Al(OH)3的离子方程式_______________________________。
(3)实验室里用NaAlO2 溶液制取Al(OH)3最好选用________(填序号)。
A.NaOH溶液 B.稀硫酸 C.二氧化碳
(4)取54g铝土矿进行实验,最后得到氧化铝51g,则该铝土矿中铝的含量为______(假设实验过程没有损失)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气(主要成分是CH4)为原料经合成气(主要成分为CO、H2)制化学品,是目前天然气转化利用的主要技术路线。而采用渣油、煤、焦炭为原料制合成气,常因含羰基铁[Fe(CO)5]等而导致以合成气为原料合成甲醇和合成氨等生产过程中的催化剂产生中毒。请回答下列问题:
(1)[Fe(CO)5]中铁的化合价为0,写出铁原子的基态电子排布式:_____________________。
(2)与CO互为等电子体的分子和离子分别为________和________(各举一种即可,填化学式),CO分子的电子式为________,CO分子的结构式可表示成________。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有___,CH3OH的熔、沸点比CH4高,其主要原因是__________。
(4)CH3CHO分子中,—CH3中的碳原子采取________杂化方式,—CHO中的碳原子采取________杂化方式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的有关数据,根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g/cm3
质量分数:36.5%
(1)该浓盐酸的物质的量浓度是___mol/L。
(2)取用任意体积的浓盐酸时,下列物理量不随所取体积的多少而变化的是___。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生用上述浓盐酸和蒸馏水配制100mL物质的量浓度为2.00mol/L的稀盐酸。
①该学生需要量取___mL(保留一位小数)上述浓盐酸进行配制。
②需要使用的实验仪器有:烧杯、玻璃棒、量筒、__和___。
③配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在横线上填写“偏大”、“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视___;
b.向容量瓶中滴加蒸馏水定容时俯视__;
c.转移前,容量瓶中含有少量蒸馏水__。
(4)取所配制的2mol/L的稀盐酸50mL,加入足量的碳酸钙固体,求可以制得标准状况下的CO2气体体积___?若忽略反应过程中的体积变化,求所得溶液中CaCl2的物质的量浓度?(写出解题过程)。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 若把H2S分子写成H3S分子,违背了共价键的饱和性
B. H3O+离子中存在配位键
C. 已知X、Y元素同周期,且电负性X>Y, 第一电离能X一定大于Y
D. 在面心立方堆积的金属晶体中,属于1个晶胞的金属原子有4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等)来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程,关于该流程下列说法正确的是( )
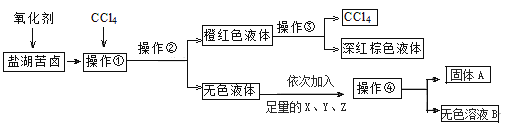
A.操作①、③对应的分别是萃取、分液
B.操作④需要的主要玻璃仪器除烧杯外,还需要蒸馏烧瓶
C.X、Y、Z 可以分别是BaCl2、KOH、K2CO3
D.要得到纯净的氯化钾晶体,必须在无色溶液B中加入稀硫酸至中性,然后蒸发结晶即可
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com