
【题目】某铝土矿主要含Al2O3。某课题组以此为原料回收氧化铝,设计实验流程如下:
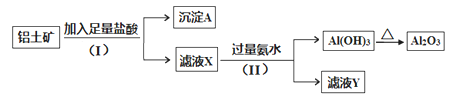
(1)步骤(I)中分离溶液和沉淀的操作名称是______,实验中除了烧杯和玻璃棒外,还需要用到的玻璃仪器是______________。
(2)写出步骤(Ⅱ)中生成Al(OH)3的离子方程式_______________________________。
(3)实验室里用NaAlO2 溶液制取Al(OH)3最好选用________(填序号)。
A.NaOH溶液 B.稀硫酸 C.二氧化碳
(4)取54g铝土矿进行实验,最后得到氧化铝51g,则该铝土矿中铝的含量为______(假设实验过程没有损失)。
【答案】过滤 漏斗 Al 3+ +3NH3·H2O= Al(OH)3+3NH4+ C 50﹪
【解析】
由流程可知,铝土矿中加足量盐酸,氧化铝被溶解,过滤得到沉淀A为SiO2,滤液X中含Al3+,滤液X中加过量氨水反应生成氢氧化铝沉淀和氯化铵,过滤得到沉淀Al(OH)3,氢氧化铝加热分解生成氧化铝和水,滤液Y为氯化铵溶液,据此分析解答。
(1)步骤(I)中分离溶液和沉淀的操作是过滤,实验中除了烧杯和玻璃棒外,还需要用到的玻璃仪器是漏斗,故答案为:过滤;漏斗;
(2)步骤(Ⅱ)中生成Al(OH)3的反应是氯化铝溶液中铝离子和氨水反应生成氢氧化铝沉淀和氯化铵,反应的离子方程式为Al3++3NH3H2O═Al(OH)3↓+3NH4+,故答案为:Al3++3NH3H2O═Al(OH)3↓+3NH4+;
(3)氢氧化铝是两性氢氧化物,易溶于氢氧化钠和硫酸溶液,用NaAlO2溶液制取Al(OH)3最好是通入过量二氧化碳制备,偏铝酸钠溶液与二氧化碳反应,生成氢氧化铝和碳酸氢钠,反应方程式为NaAlO2+CO2+2H2O═Al(OH)3↓+NaHCO3,故答案为:C;
(4)取54g铝土矿进行实验,最后得到氧化铝51g,实验过程没有损失,由铝元素守恒可知,则该铝土矿中铝的含量为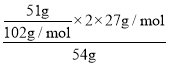 ×100%=50%,故答案为:50%。
×100%=50%,故答案为:50%。


科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。说法正确的是( )
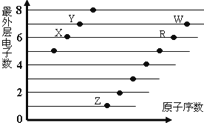
A. X与W形成的化合物中只有共价键
B. X与Z形成的化合物中只有离子键
C. 元素的非金属性:X>R>W
D. 简单离子的半径:W>R>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中正确的是
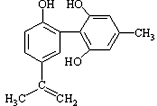
A. 该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B. 滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C. 1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol
D. 该分子中的所有碳原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,制取氯化锌晶体的工艺流程如下:
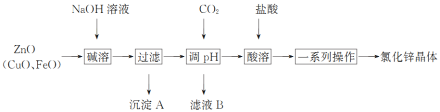
已知:Zn及其化合物的性质与Al及其化合物的性质相似,pH>11时,Zn(OH)2能溶于NaOH溶液生成ZnO22—。
(1)“调pH”步骤中通入过量CO2时发生反应的化学方程式为________;“酸溶”时发生反应的离子方程式为___________。
(2)下列说法不正确的是_______。
A 加入过量NaOH溶液的目的是提高锌元素的浸取率
B 沉淀A的主要成分是CuO、FeO
C 洗涤沉淀时,直接将洗涤剂加入漏斗,并用玻璃棒轻轻搅拌
D 利用结晶法可以从氯化锌溶液中获得氯化锌晶体
(3)流程中需进行蒸发浓缩,在实验室中进行蒸发浓缩的具体操作是_____。
(4)氯化锌晶体是白色晶体,可含1、1.5、2.5、3、4个结晶水,易潮解,易溶于水,溶于乙醇、丙酮。由氯化锌晶体制备无水氯化锌的装置如图,其中滴液漏斗中盛放的是SOCl2(SOCl2熔点为105 ℃、沸点为78.8 ℃、遇水剧烈水解生成两种酸性气体)。
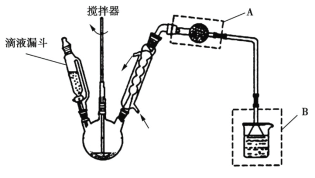
①下列物质中最适合洗涤氯化锌晶体的是_________。
A 冷水 B 浓盐酸 C 乙醇 D 氨水
②仪器A的名称为_______;装置B的作用是_________。
③以ZnCl2·H2O为例,写出三颈烧瓶中发生反应的化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如右。下列说法不正确的是

A. 该过程将太阳能转化成为化学能
B. 该过程中,只涉及极性键的断裂与生成
C. 氧化剂与还原剂的物质的量之比为1∶3
D. 原料气N2可通过分离液态空气获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某碳酸氢钠样品的纯度,取21g含有杂质的碳酸氢钠样品投入到100mL未知浓度的盐酸中,两者恰好完全反应(杂质不反应),生成二氧化碳气体4.48L(标准状况)。
(1)该碳酸氢钠样品中碳酸氢钠的纯度________________。
(2)盐酸的物质的量浓度______________________。
要求:写出相关方程式及详细计算公式和步骤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
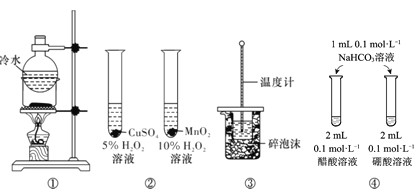
A.方案①用于分离I2和NH4Cl固体
B.方案用于比较CuSO4和MnO2的催化活性
C.方案③用于测定中和热
D.方案④用于比较醋酸和硼酸的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p2;②1s22s22p63s23p3;③1s22s22p4;④1s22s22p3。则下列有关比较中正确的是( )
A. 电负性:④>③>②>①
B. 原子半径:③>④>②>①
C. 第一电离能:④>③>②>①
D. 最高正化合价:③>④=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试剂瓶上贴有如下标签“100mL 1.0molL-1MgCl2 溶液”,对该试剂理解正确的是( )
A.该溶液中含有的微粒主要有:MgCl2、Mg2+、Cl-、H2O
B.若取 50mL 溶液,其中的 c(Cl-)=1 molL﹣1
C.取该溶液5.0 mL恰好与0.1 molL-1 AgNO3100 mL溶液完全反应
D.取10mL该溶液加水10 mL,所得MgCl2溶液的浓度为0.5 molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com