
【题目】某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等)来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程,关于该流程下列说法正确的是( )
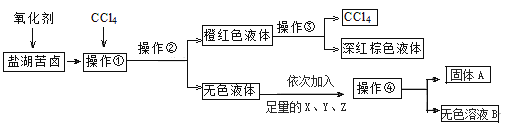
A.操作①、③对应的分别是萃取、分液
B.操作④需要的主要玻璃仪器除烧杯外,还需要蒸馏烧瓶
C.X、Y、Z 可以分别是BaCl2、KOH、K2CO3
D.要得到纯净的氯化钾晶体,必须在无色溶液B中加入稀硫酸至中性,然后蒸发结晶即可
【答案】C
【解析】
根据题意,加氧化剂主要是置换出溴单质,因此加氯气,操作①是萃取,操作②是分液,操作③是蒸馏,操作②分液得到的物质加入过量氯化钡除掉硫酸根杂质,加入过量氢氧化钾和碳酸钾,再过滤,最后到KCl和多余的碳酸钾和KOH溶液,再加盐酸调节pH。
A选项,根据分析操作①是萃取,操作③是蒸馏,故A错误;
B选项,操作④过滤,需要的主要玻璃仪器除烧杯外,还需要玻璃棒、漏斗,故B错误;
C选项,根据分析X、Y、Z 可以分别是BaCl2、KOH、K2CO3,加入过量氯化钡除掉硫酸根杂质,加入过量氢氧化钾除去镁离子,加入碳酸钾除去过量钡离子,再过滤,且KOH和K2CO3可以交换加入顺序,故C正确;
D选项,要得到纯净的氯化钾晶体,应该无色溶液B中加入稀盐酸至中性,然后蒸发结晶,故D错误;
综上所述,答案为C。


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
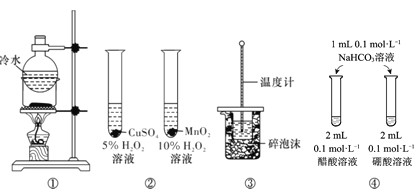
A.方案①用于分离I2和NH4Cl固体
B.方案用于比较CuSO4和MnO2的催化活性
C.方案③用于测定中和热
D.方案④用于比较醋酸和硼酸的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家模仿植物的光合作用,开发出了利用太阳光、水及二氧化碳(CO2)合成甲烷(CH4)的人工光合系统,其工作原理如图所示。下列说法错误的是( )
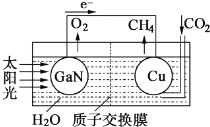
A. GaN为负极,Cu为正极 B. 该装置中只存在两种能量的转化
C. GaN电极的电极反应式为2H2O-4e-=4H++O2↑ D. 该装置工作时,H+向Cu电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试剂瓶上贴有如下标签“100mL 1.0molL-1MgCl2 溶液”,对该试剂理解正确的是( )
A.该溶液中含有的微粒主要有:MgCl2、Mg2+、Cl-、H2O
B.若取 50mL 溶液,其中的 c(Cl-)=1 molL﹣1
C.取该溶液5.0 mL恰好与0.1 molL-1 AgNO3100 mL溶液完全反应
D.取10mL该溶液加水10 mL,所得MgCl2溶液的浓度为0.5 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B. 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C. NH4HCO3溶液和过量的NaOH溶液混合:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-= 2Fe2++I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素 CO(NH2)2,原理如图。下列有关说法正确的是
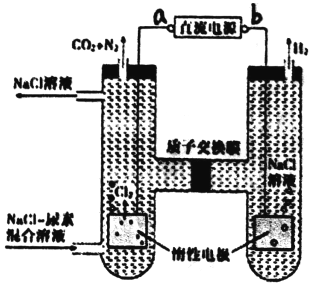
A. a为电源的负极
B. 电解前后,阴极室溶液的pH不变
C. 阳极室中发生的电极反应为2H++2e-=H2↑
D. 若两极共收集到气体产品13.44L,则除去的尿素为7.2g(忽略气体的溶解)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)计算在0.2 g H2中含有____个H原子,2 mol CO(NH2)2中含___mol C,___mol N,___mol H,标准状况下,44.8 L O2的体积为___mol。
(2) 2.3 g Na中含___mol e-,在与足量水反应中产生标准状况下的H2___L。
(3) 0.4 mol Al2(SO4)3的溶液中,含__mol SO42—,Al3+物质的量__0.8 mol(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒被誉为“合金的维生素”。从废钒(主要成分为V2O5、Fe2O3、SiO2等)中回收V2O5的一种工艺流程如下图所示:

已知:
步骤②、③中的变化过程可简化为:Rn+(水层)+nHA(有机层)![]() RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
RAn(有机层)+nH+(水层)(式中Rn+表示VO2+或Fe3+,HA表示有机萃取剂)
回答下列问题:
(1)步骤D酸浸过程中发生氧化还原反应的化学方程式为______________________。
(2)萃取时应加入适量碱的作用是___________________。
(3)步骤④中反应的离子方程式为___________________。
(4)步骤⑤加入氨水调节溶液pH=2,钒沉淀率达到93%且不产生Fe(OH)3沉淀,则此时溶液中c(Fe3+)<_____mol/L(按25℃计算,25℃时Ksp[Fe(OH)3]=2.6×10-39)。所得NH4VO3为离子化合物,NH4+的电子式为_______。
(5)V2O5是两性氧化物,在强酸性溶液中以VO2+形式存在,VO2+具有强氧化性,能将I-氧化为I2,本身被还原为V0+,则V2O5与氢碘酸反应的离子方程式为_________________。
(6)为提高钒的回收率,步骤②和③需多次进行,假设酸浸所得“强酸性浸出液”中c(VO2+)=amol/L,步骤②和③每进行一次,VO2+萃取率为80%,4次操作后,“强酸性浸出液中”c(VO2+)=_______mol/L(萃取的量=![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(NOx)是大气污染物之一。工业上在一定的温度和催化剂条件下,可用NH3来消除NOx的污染,生成两种对环境无害的物质。
(1)请写出NH3与NO2反应的化学方程式____。
(2)①写出实验室中由固体物质制取氨气的化学方程式__;
②欲收集一瓶干燥的氨气,选择下图中的装置,其连接顺序为:发生装置→____(按气流方向,用小写字母表示)
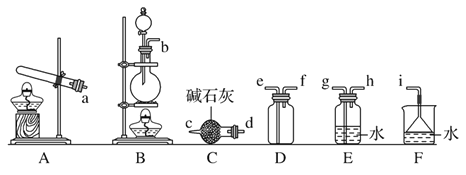
(3)电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验。

①写出电解时NO2发生反应的电极反应式:___。
②若有标准状况下2.24LNO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为__mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com