
【题目】如图为实验室某浓盐酸试剂瓶上的有关数据,根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g/cm3
质量分数:36.5%
(1)该浓盐酸的物质的量浓度是___mol/L。
(2)取用任意体积的浓盐酸时,下列物理量不随所取体积的多少而变化的是___。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生用上述浓盐酸和蒸馏水配制100mL物质的量浓度为2.00mol/L的稀盐酸。
①该学生需要量取___mL(保留一位小数)上述浓盐酸进行配制。
②需要使用的实验仪器有:烧杯、玻璃棒、量筒、__和___。
③配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在横线上填写“偏大”、“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视___;
b.向容量瓶中滴加蒸馏水定容时俯视__;
c.转移前,容量瓶中含有少量蒸馏水__。
(4)取所配制的2mol/L的稀盐酸50mL,加入足量的碳酸钙固体,求可以制得标准状况下的CO2气体体积___?若忽略反应过程中的体积变化,求所得溶液中CaCl2的物质的量浓度?(写出解题过程)。___
【答案】11.9 BD 16.8 100mL容量瓶 胶头滴管 偏小 偏大 无影响 1.12L 1mol/L
【解析】
(1)根据![]() 计算该浓盐酸的物质的量浓度;
计算该浓盐酸的物质的量浓度;
(2)根据该物理量是否与溶液的体积有关判断;
(3)①根据稀释前后溶质物质的量不变计算浓盐酸的体积;
②根据实验步骤判断需要的仪器;
③根据![]() 判断误差;
判断误差;
(4)根据方程式![]() 计算。
计算。
(1)该浓盐酸的物质的量浓度![]() 11.9 mol·L-1;
11.9 mol·L-1;
(2)A.溶液中HCl的物质的量n=cV,所以与溶液的体积有关,故不选A;
B.溶液的浓度![]() ,与溶液的体积无关,故选B;
,与溶液的体积无关,故选B;
C.溶液中Cl-的数目N=cVNA,所以与溶液的体积有关,故不选C;
D.溶液的密度与溶液的体积无关,故选D;
(3)①设需要量取VmL上述浓盐酸,则11.9 mol·L-1×VmL=100mL×2.00mol/L,V=16.8mL;
②配制该溶液需要用25mL的量筒量取16.8mL浓盐酸,在烧杯中溶解,然后转移到100 mL容量瓶中,并用胶头滴管定容,需要的仪器是25mL量筒、烧杯、玻璃棒、100 mL容量瓶、胶头滴管,缺少的仪器是100mL容量瓶、胶头滴管;
③a.用量筒量取浓盐酸时俯视,浓盐酸体积偏小,所配制的稀盐酸的物质的量浓度小;
b.向容量瓶中滴加蒸馏水定容时俯视,溶液体积偏小,所配制的稀盐酸的物质的量浓度大;
c.转移前,容量瓶中含有少量蒸馏水,所配制的稀盐酸的物质的量浓度无影响。
(4)50mL 2mol/L的稀盐酸中溶质的物质的量是0.05L× 2mol/L=0.1mol,设生成标准状况下的CO2气体体积VL,生成CaCl2的物质的量为ymol;
![]()
2mol 1mol 22.4L
0.1mol ymol VL
![]() 、
、![]()
V=1.12L、y=0.05mol,
所得溶液中CaCl2的物质的量浓度![]() 1mol/L。
1mol/L。


科目:高中化学 来源: 题型:
【题目】下列各组微粒的空间构型相同的是
①NH3和H2O ②NH4+和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和C2H2 ⑥SiO44-和SO42-
A. ②⑤B. ②③⑥C. ①②③④D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如右。下列说法不正确的是

A. 该过程将太阳能转化成为化学能
B. 该过程中,只涉及极性键的断裂与生成
C. 氧化剂与还原剂的物质的量之比为1∶3
D. 原料气N2可通过分离液态空气获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
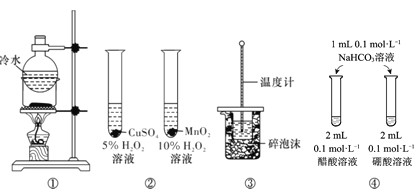
A.方案①用于分离I2和NH4Cl固体
B.方案用于比较CuSO4和MnO2的催化活性
C.方案③用于测定中和热
D.方案④用于比较醋酸和硼酸的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为元素周期表中的一部分,表中列出了10种元素在周期表中的位置,按要求完成下列各小题。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | Ⅵ A | Ⅶ A | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
I.(1)这10种元素中,化学性质最不活泼的元素是____(填元素符号,下同),非金属性最强的元素是___。
(2)①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的电子式是
(3)①②③三种元素的原子半径由大到小的顺序是____。
(4)某元素的最高价氧化物对应的水化物既能与酸反应生成盐和水又能和碱反应生成盐和水,向该元素和⑨号元素形成的化合物的溶液中,缓慢滴加氢氧化钠溶液至过量,产生的实验现象是____,有关反应的离子方程式为_____。
II.下列物质:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩Ar
(1)既含有极性键又含有非极性键的是____;(填序号,下同)
(2)含有非极性键的离子化合物是____;
(3)不含化学键的是____;
(4)用电子式表示Na2O的形成过程_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p2;②1s22s22p63s23p3;③1s22s22p4;④1s22s22p3。则下列有关比较中正确的是( )
A. 电负性:④>③>②>①
B. 原子半径:③>④>②>①
C. 第一电离能:④>③>②>①
D. 最高正化合价:③>④=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过计算填写下列内容:
(1)2.5mol CH4的质量是____________;标准状况下的体积为_______________。
(2)1.5NA个H3PO4含氧原子的物质的量为_________。
(3)12g某二价金属的硫酸盐中,含有0.1mol SO![]() ,该金属的相对原子质量为________。
,该金属的相对原子质量为________。
(4)实验测得CO、N2和O2等三种气体的混合气体的密度是H2的15.5倍,其中O2的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家模仿植物的光合作用,开发出了利用太阳光、水及二氧化碳(CO2)合成甲烷(CH4)的人工光合系统,其工作原理如图所示。下列说法错误的是( )
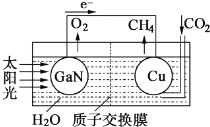
A. GaN为负极,Cu为正极 B. 该装置中只存在两种能量的转化
C. GaN电极的电极反应式为2H2O-4e-=4H++O2↑ D. 该装置工作时,H+向Cu电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)计算在0.2 g H2中含有____个H原子,2 mol CO(NH2)2中含___mol C,___mol N,___mol H,标准状况下,44.8 L O2的体积为___mol。
(2) 2.3 g Na中含___mol e-,在与足量水反应中产生标准状况下的H2___L。
(3) 0.4 mol Al2(SO4)3的溶液中,含__mol SO42—,Al3+物质的量__0.8 mol(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com