
【题目】如表为元素周期表中的一部分,表中列出了10种元素在周期表中的位置,按要求完成下列各小题。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | Ⅵ A | Ⅶ A | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
I.(1)这10种元素中,化学性质最不活泼的元素是____(填元素符号,下同),非金属性最强的元素是___。
(2)①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的电子式是
(3)①②③三种元素的原子半径由大到小的顺序是____。
(4)某元素的最高价氧化物对应的水化物既能与酸反应生成盐和水又能和碱反应生成盐和水,向该元素和⑨号元素形成的化合物的溶液中,缓慢滴加氢氧化钠溶液至过量,产生的实验现象是____,有关反应的离子方程式为_____。
II.下列物质:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩Ar
(1)既含有极性键又含有非极性键的是____;(填序号,下同)
(2)含有非极性键的离子化合物是____;
(3)不含化学键的是____;
(4)用电子式表示Na2O的形成过程_____。
【答案】Ne F ![]() K>Na>Mg 先产生白色沉淀后沉淀逐渐溶解 Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O ⑧ ⑤ ⑩
K>Na>Mg 先产生白色沉淀后沉淀逐渐溶解 Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O ⑧ ⑤ ⑩ ![]()
【解析】
I.由元素在周期表中的位置可以知道:①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为F、⑨为Cl、⑩为Ne; 据以上各元素的性质及其形成的化合物性质进行分析;
II. 非金属元素之间可形成共价键,同种原子间形成非极性键,不同种原子间形成极性键;活泼金属与活泼非金属元素原子间易形成离子键;离子化合物中一定含有离子键,可能含有共价键;稀有气体分子间不存在化学键。
I.由元素在周期表中的位置可以知道:①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为F、⑨为Cl、⑩为Ne;
(1)稀有气体Ne的性质最稳定,F的非金属性最强;
(2)金属性越强,对应碱的碱性越强,则①③⑤三种元素的最高价氧化物对应水化物中,碱性最强的化合物的化学式是NaOH,其属于离子化合物,电子式为:![]() ;
;
(3)电子层越多,原子半径越大,同周期从左向右原子半径减小,则①②③三种元素的原子半径由大到小的顺序是K>Na>Mg;
(4)某元素的最高价氧化物对应的水化物既能与酸反应生成盐和水又能和碱反应生成盐和水,符合条件的物质为氢氧化铝;该元素为铝元素,铝元素和氯元素形成的化合物为AlCl3,向氯化铝溶液中缓慢滴加氢氧化钠溶液至过量,先产生白色沉淀后沉淀逐渐溶解,有关反应的离子方程式为:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O;
II. ①N2分子中只含有氮氮非极性共价键;②CO2分子中只含有碳氧极性共价键,属于共价化合物;③NH3分子中只含有氮氢极性共价键,属于共价化合物;④Na2O属于离子化合物,含有钠离子和氧离子,只含有离子键;⑤Na2O2属于离子化合物,钠离子和过氧根离子之间存在离子键,氧氧原子之间为非极性键;⑥NaOH属于离子化合物,钠离子和氢氧根离子之间存在离子键,氢氧原子之间为极性键;⑦CaBr2属于离子化合物,钠离子和溴离子之间存在离子键;⑧H2O2属于共价化合物,氢氧原子间为极性键,氧氧原子之间存在非极性键;⑨NH4Cl中含有氮氢极性共价键和铵根离子与氯离子之间的离子键;⑩Ar属于单原子分子,不存在化学键;结合以上分析可知:
(1)既含有极性键又含有非极性键的是⑧;
(2)含有非极性键的离子化合物是⑤;
(3)不含化学键的是⑩;
(4)Na2O属于离子化合物,用电子式表示Na2O的形成过程如下:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列中心原子的杂化轨道类型和分子几何构型不正确的是
A. PCl3中P原子sp3杂化,为三角锥形
B. BCl3中B原子sp2杂化,为平面三角形
C. CS2中C原子sp杂化,为直线形
D. H2S分子中,S为sp杂化,为直线形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肯定属于同族元素且性质相似的是( )
A. 原子核外电子排布式:A为1s22s2,B为1s2
B. 结构示意图:A为![]() ,B为
,B为![]()
C. A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D. A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出符合下列要求的符号。
(1)第二电子层 s能级________。
(2)n=3 p能级________。
(3)第五电子层 d能级________。
(4)n=4 p能级________。
(5)铜氨络离子的结构式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的有关数据,根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g/cm3
质量分数:36.5%
(1)该浓盐酸的物质的量浓度是___mol/L。
(2)取用任意体积的浓盐酸时,下列物理量不随所取体积的多少而变化的是___。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生用上述浓盐酸和蒸馏水配制100mL物质的量浓度为2.00mol/L的稀盐酸。
①该学生需要量取___mL(保留一位小数)上述浓盐酸进行配制。
②需要使用的实验仪器有:烧杯、玻璃棒、量筒、__和___。
③配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在横线上填写“偏大”、“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视___;
b.向容量瓶中滴加蒸馏水定容时俯视__;
c.转移前,容量瓶中含有少量蒸馏水__。
(4)取所配制的2mol/L的稀盐酸50mL,加入足量的碳酸钙固体,求可以制得标准状况下的CO2气体体积___?若忽略反应过程中的体积变化,求所得溶液中CaCl2的物质的量浓度?(写出解题过程)。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂,常见制备方法如下。
(1)氯酸钾氧化法:化学反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KC1+3C12,每生成3mol KH(IO3)2,反应中转移的电子数为______,向反应后溶液中加______溶液得到KIO3。
(2)一种由含碘废水制取碘酸钾的工艺如图:

①进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加______盐溶液来检验其是否已洗涤干净。
②“制FeI2”时,发生反应的化学方程式为______。
③在KIO3、KHSO3的酸性混合溶液中加入少量KI(催化剂)和淀粉,不停地搅拌,反应机理为:第一步IO3-+5I-+6H+=3I2+3H2O第二步反应的离子方程式为______。
当反应进行到1.5min时,溶液突然变为蓝色,随之又很快消失,则第______步反应速率快。
④改变反应温度,重复上述实验,得到温度(T)与溶液变蓝所需时间(t)的关系如图所示(超过50℃后溶液不会再变蓝)。根据图象,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系:_________。

(3)山东省已下调食用盐碘含量标准每千克盐含碘25毫克(波动范围为18~33mgkg-1)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4molL-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。计算该食盐试样中碘元素的含量______mgkg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家研发了“全氢电池”,其工作原理如图所示。下列有关该电池工作时的说法,正确的是( )
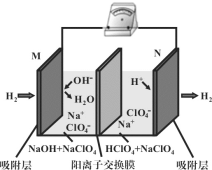
A. 电解质溶液中,Na+向左移动
B. 该电池的总反应为H+ + OH- = H2O
C. 电子由N电极经导线流向M电极
D. 导线上通过1mole-,装置内H2总量减少0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S的分解反应是一个可逆反应,其能量与反应进程的关系如图所示,下列有关说法正确的是( )

A. 正反应的活化能大于逆反应的活化能
B. 若减小体系的压强,则该反应的焓变将增大
C. 升高温度,化学反应速率加快,H2S的平衡转化率减小
D. 向密闭容器中充入1molH2S充分反应,吸收84.9kJ的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com