
【题目】下列各组微粒的空间构型相同的是
①NH3和H2O ②NH4+和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和C2H2 ⑥SiO44-和SO42-
A. ②⑤B. ②③⑥C. ①②③④D. ③④⑤⑥
【答案】D
【解析】
①NH3中价层电子对个数=3+![]() =4且含有一个孤电子对,即N原子为sp3杂化,所以为三角锥形,H2O中心原子价层电子对个数=2+
=4且含有一个孤电子对,即N原子为sp3杂化,所以为三角锥形,H2O中心原子价层电子对个数=2+![]() =4且含有两个孤电子对,即O原子为sp3杂化,所以为V形结构,二者空间构型不同,故①不符合题意;
=4且含有两个孤电子对,即O原子为sp3杂化,所以为V形结构,二者空间构型不同,故①不符合题意;
②根据价层电子互斥理论可知,NH4+为正四面体形结构,H3O+中价层电子对个数是4且含有一对孤电子对,所以为三角锥形结构,二者空间构型不同,故②不符合题意;
③NH3为三角锥形结构、H3O+为三角锥形结构,所以二者空间构型相同,故③符合题意;
④O2、SO2中价层电子对个数都是3且都含有一对孤电子对,所以分子空间构型都是V形,故④符合题意;
⑤CO2和C2H2分子都是直线型分子,故⑤符合题意;
⑥SiO44-和SO42-中价层电子对个数都是4且不含孤电子对,所以空间构型都是正四面体结构,所以空间构型相同,故⑥符合题意;
故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 标况下,224 L H2O含有的分子数为10NA
B. 1 mol任何气体所含的原子数均为NA
C. 28 g CO所含的分子数为NA
D. 标况下,NA个分子的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列关于充电电池、干电池的叙述合理的是___________。
①干电池可以实现化学能向电能的转化和电能向化学能的转化
②锌锰干电池长时间连续使用时内装糊状物可能流出腐蚀电器
③充电电池可以无限制地反复放电、充电
④充电是使放电时的氧化还原反应逆向进行
(2)铅蓄电池中,正极材料为PbO2,负极材料为Pb,放电时其负极反应式为_____________。
(3)原电池在NaOH溶液介质中,铝为负极,其负极反应式为_______________。
(4)如图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图。b电极是_____极,请写出负极的电极反应方程式:___________________________。
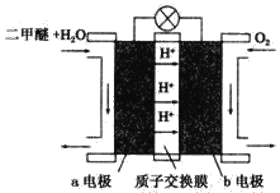
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿(主要成分为MnO2,还含有少量的Fe2O3、FeO、Al2O3和SiO2)为原料制备马日夫盐[Mn(H2PO4)2·2H2O(磷酸二氢锰)]的主要工艺流程如图:
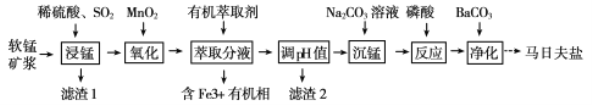
(1)用MnO2“氧化”时发生反应的离子方程式为__________________________________。
(2)如何检验“沉锰”己完成_____________________________________________________。
(3)铁离子的萃取率与接触时间和溶液的pH之间的关系如图1、2所示,则应选择的接触时间为_______;pH>1.7,铁离子的萃取率急剧下降的原因可能为____________________。
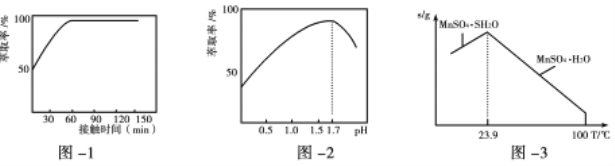
(4)结合图3的溶解度曲线,请补充完整由浸锰得到的溶液制备MnSO4·H2O的实验方案:边搅拌边向溶液中滴加适量的双氧水,再向滤液中加入MnCO3粉末调节溶液的pH范围为_________,过滤洗涤,将滤液与洗涤液合并,控制温度在80℃~90℃之间蒸发浓缩、______________,(填操作名称)得到MnSO4·H2O,用80℃~90℃的蒸馏水洗涤2~3次,放在真空干燥箱中低温干燥。[已知该溶液中pH=7.8时Mn(OH)2开始沉淀:pH=5.0时Fe(OH)3、Al(OH)3沉淀完全,pH=8.8时Fe(OH)2沉淀完全]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中心原子的杂化轨道类型和分子几何构型不正确的是
A. PCl3中P原子sp3杂化,为三角锥形
B. BCl3中B原子sp2杂化,为平面三角形
C. CS2中C原子sp杂化,为直线形
D. H2S分子中,S为sp杂化,为直线形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知17g H2R中含1mol H,则R的摩尔质量为__________。
(2)同温同压下,等体积的NH3气和H2S气的质量之比为__________。
(3)若由NH3和H2S组成的混合气体的平均相对分子质量为20.4,则混合气中NH3和H2S的分子数之比为__________。
(4)配制500mL 0.2mol/L Na2CO3溶液,需要用托盘天平称量![]() 晶体的质量为__________ g。
晶体的质量为__________ g。
(5)将a L标准状况下的氯化氢气体溶于100mL水中(水的密度近似为1g/mL),得到密度为ρ g/mL的盐酸,则该盐酸的物质的量浓度是____________________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的有
①0.1mol丙烯酸中含有双键的数目为0.1NA
②12g金刚石中,碳碳共价键数为4NA
③常温下,21g C3H6和C4H8的混合物中含有的碳原子数为1.5NA
④2g ![]() 中含有的质子数、中子数、电子数均为NA
中含有的质子数、中子数、电子数均为NA
⑤常温常压下,S2和S6的混合物共6.4g,其中所含硫原子数一定为0.2NA
⑥10mL 18mol/L的浓硫酸与足量的镁反应时转移的电子数为0.18NA
A. ①⑥B. ④⑤⑥C. ③④⑤D. ①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用印刷电路的废腐蚀液(含有大量CuCl2、FeCl2和FeCl3)回收Cu,主要流程如下:
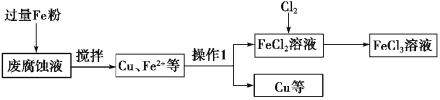
(1)操作1的名称是__________,需要用到的玻璃仪器有________________________。
(2)加入过量铁粉发生的离子反应有_______________。
(3)获得的铜粉中含有杂质,除杂所需的试剂是_______________(填化学式)。
(4)实验室利用如图所示装置制取一定量的FeCl3。
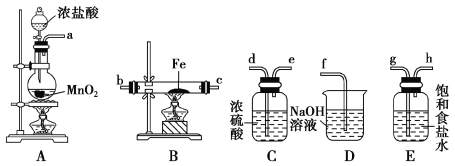
各装置的正确连接顺序为(填写装置代号)A→______→______→______→D。装置C的作用是____________________________,写出装置D中反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的有关数据,根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g/cm3
质量分数:36.5%
(1)该浓盐酸的物质的量浓度是___mol/L。
(2)取用任意体积的浓盐酸时,下列物理量不随所取体积的多少而变化的是___。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生用上述浓盐酸和蒸馏水配制100mL物质的量浓度为2.00mol/L的稀盐酸。
①该学生需要量取___mL(保留一位小数)上述浓盐酸进行配制。
②需要使用的实验仪器有:烧杯、玻璃棒、量筒、__和___。
③配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在横线上填写“偏大”、“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视___;
b.向容量瓶中滴加蒸馏水定容时俯视__;
c.转移前,容量瓶中含有少量蒸馏水__。
(4)取所配制的2mol/L的稀盐酸50mL,加入足量的碳酸钙固体,求可以制得标准状况下的CO2气体体积___?若忽略反应过程中的体积变化,求所得溶液中CaCl2的物质的量浓度?(写出解题过程)。___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com