
����Ŀ��Si3N4��һ����Ҫ���������ǽ������ϣ��ܱ�ǿ�ʴ��ʵ���ҿ�����SiCl4������NH3��1400�桢��ˮ�����������·�Ӧ��ȡ�����裬ʵ��װ��ʾ��ͼ�����Ⱥͼг�װ����ȥ�����й��������£�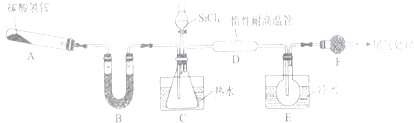
���� | �۵�/�� | �е�/�� | |
SiCl4 | ��70 | 57.7 | ���ܽ�NH3�����Σ��ڳ�ʪ�����м���ˮ�� |
Si3N4 | 1900 | �� | �����ȶ� |
��ش��������⣺
��1��װ��B����������Լ�����Ϊ ��
��2��װ��C�е���ƿ��Ҫ��ˮԡ����ˮԡ���ȵ��ŵ�Ϊ ��
��3����Ӧ��ʼǰ����װ������������������裩���ټ�װҩƷ���������IJ��������밴��ȷ��˳����д���в������ţ���
�ٵμ�SiCl4�ڼ���װ��D �ۼ���װ��A
��4��װ��D�з�����Ӧ�Ļ�ѧ����ʽΪ ��
��5����Ӧ�����У�װ��E�е�����Ϊ ��
��6���ⶨ��Ʒ�� Si3N4�ĺ���������Ϊ��
������Ӧ������ȡ200.0gװ��D�е����ʣ���������NaOH��Һ����ּ��ȷ�Ӧ��
���������ɵ�����ȫ����200.0mL3.000molL��1�������գ���Һ����仯���Բ��ƣ���
����ȡ���պ�������Һ20.00mL����0.2500molL��1NaOH��Һ�ζ��������
�����ظ��ζ�3�Σ�ƽ������NaOH��Һ32.00mL��
�ٲ��袡�з�����Ӧ�����ӷ���ʽΪ ��
�ڲ�Ʒ��Si3N4����������Ϊ������3λ��Ч���֣�
��7��Si3N4����ʴ������ǿ�����ױ�����ḯʴ����Ӧ�����ķ������һ����Σ����εĻ�ѧʽΪ ��
���𰸡�
��1����ʯ��
��2��ҩƷ���Ⱦ��ȣ��������¶�
��3�����װ�õ������ԣ��ۢڢ�
��4��3SiCl4+4NH3 ![]() Si3N4+12HCl
Si3N4+12HCl
��5������ɫҺ�����ɣ�����������
��6��Si3N4+6OH��+3H2O=3SiO32��+4NH3����9.10%
��7��NH4F
���������⣺������Ŀ��������Ϣ��A�м���̼����粒���ֽ��Ʊ�������BΪ��ȥ�ֽ�����Ķ�����̼��ˮ�����ij���װ�ã�CΪ������SiCl4�������Ȼ��װ�ã�DΪSiCl4������NH3��1400�桢��ˮ�����������·�Ӧ��ȡ������װ�ã�EΪ�����ռ�װ�ã�FΪβ������װ�ã���1��A�м���̼����粒���ֽ��Ʊ�������BΪ��ȥ�ֽ�����Ķ�����̼��ˮ�����ij���װ�ã��Լ�ѡ�ü�ʯ�ң�
���Դ��ǣ���ʯ�ң���2��C�е���ƿ��Ҫ��ˮԡ����ˮԡ���ȵ��ŵ�ΪҩƷ���Ⱦ��ȣ��������¶ȣ�
���Դ��ǣ�ҩƷ���Ⱦ��ȣ��������¶ȣ���3����Ӧ��ʼǰ����װ�����������װ�õ������ԣ��ټ�װҩƷ������װ��A�Ʊ��������μ�SiCl4 �� ʹ���ఱ�����Ȼ�ϣ��ټ���װ��D�����䷢����Ӧ�Ʊ������裬
���Դ��ǣ����װ�õ������ԣ��ۢڢ٣���4��װ��D��Ϊ������SiCl4������Ӧ��װ�ã���ѧ����ʽΪ3SiCl4+4NH3 ![]() Si3N4+12HCl��
Si3N4+12HCl��
���Դ��ǣ�3SiCl4+4NH3 ![]() Si3N4+12HCl����5�����ݷ�Ӧ3SiCl4+4NH3
Si3N4+12HCl����5�����ݷ�Ӧ3SiCl4+4NH3 ![]() Si3N4+12HCl�����ɵĵ����������Ϊ��ɫҺ��HCl�����ӷ������İ�����ϳ��Ȼ�泥��������̵�����
Si3N4+12HCl�����ɵĵ����������Ϊ��ɫҺ��HCl�����ӷ������İ�����ϳ��Ȼ�泥��������̵�����
���Դ��ǣ�����ɫҺ�����ɣ����������̣���6���������ڼ��������¼���ˮ�����ɹ����ƺͰ��������������հ��������Ȼ�泥�����������������������Һ�ζ�����ȷ��ʣ������������Ӷ������백����Ӧ����������ʵ���������ȷ����Ԫ�ص����ʵ�����
�ٵ������ڼ��������¼���ˮ�����ɹ����ƺͰ��������ӷ���ʽΪSi3N4+6OH��+3H2O=3SiO32��+4NH3����
���Դ��ǣ�Si3N4+6OH��+3H2O=3SiO32��+4NH3����
��ȡ���պ�������Һ20.00mL������������������������Һ�ζ�ʱ���õ�0.2500molL��1NaOH��Һ32.00mL�����ʵ���Ϊ0.2500��0.032L=0.008mol������������������ʵ���Ϊ0.008mol����200mL�й�������������ʵ���Ϊ0.08mol�������ܵ����ʵ���Ϊ0.200L��3.000molL��1=0.6mol�����백����Ӧ����������ʵ���Ϊ0.6��0.08=0.52mol��NH3+HCl=NH4Cl������Ϊ0.52mol�����ݵ�ԭ���غ�֪��n�� Si3N4��= ![]() =0.13mol����Ʒ��Si3N4����������=
=0.13mol����Ʒ��Si3N4����������= ![]() =9.10%��
=9.10%��
���Դ��ǣ�9.10%����7��Si3N4������ᷴӦ�������ķ�����ͷ���泥�
���Դ��ǣ�NH4F��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽���У����е��� ( )
A.���״�����ʪ��pH��ֽ�ϣ��ⶨ��pH
B.���ܽ⡢���ˡ������IJ���˳�����CaCl2��CaCO3�Ļ����
C.������������Һ��ȥCO2�е�HCl����
D.����ij��Һ�Ƿ���SO42-ʱ��Ӧȡ��������Һ�����μ���BaCl2��Һ��ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������ƽ���л�ѧ����ʽ��
![]() _____________
_____________
��2����Ӧ���б�������Ԫ��_________����ԭ������________��
��3����Ӧ��ÿ���ɱ����22.4L ![]() ��ת��_______mol���ӡ�
��ת��_______mol���ӡ�
��4����Ӧ���������뻹ԭ�����ʵ���֮��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӣ�Ni��Cd���ɳ�������ִ��������й㷺Ӧ�ã���֪ij���ӵ�صĵ������ҺΪKOH��Һ����䡢�ŵ簴��ʽ���У�Cd+2NiOOH+2H2O ![]() Cd��OH��2+2Ni��OH��2 �� �йظõ�ص�˵����ȷ���ǣ� ��
Cd��OH��2+2Ni��OH��2 �� �йظõ�ص�˵����ȷ���ǣ� ��
A.���ʱ������Ӧ��Ni��OH��2��e��+OH���TNiOOH+H2O
B.�������ǻ�ѧ��ת��Ϊ���ܵĹ���
C.�ŵ�ʱ����������Һ�ļ��Բ���
D.�ŵ�ʱ�������Һ�е�OH���������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ƽ��仯������й㷺����;��
��1�������£�Ũ�Ⱦ�Ϊ0.1mol/L����������������Һ��pH�����
���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
��������Һ�е������ӣ����������������ǿ���ǣ����ݱ������ݣ�Ũ�Ⱦ�Ϊ0.01mol/L���������������Һ�ֱ�ϡ��100����pH�仯������������ţ���
A.HCN
B.HClO
C.CH3COOH
D.H2CO3
��2���Т�100mL0.1mol/L̼������ ��100mL0.1mol/L̼����������Һ����Һ��ˮ������������Ӹ��������������=����������ͬ������Һ�������ӵ����ʵ���Ũ��֮�ͣ�
��3��̼��������һ�����ǿ��������������ʣ������£�0.1mol/L̼��������Һ��pH����8���������ӷ���ʽ������ԭ����Һ��Na+��HCO3����H2CO3��CO32����OH��������Ũ���ɴ�С��˳��Ϊ�� ��
��4��ʵ�����г�����������������ϴ�����ᴿ��
�ٵ�150mL1mol/L������������Һ���ձ����2.24L������̼ʱ��������Һ�и�����Ũ���ɴ�С��˳��Ϊ��
�ڼ������ӿ�ʼ����ʱ��pH�±���
���� | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
������ͬŨ��Cu2+��Mg2+��Fe2+����Һ�еμ�����������Һʱ���������ӷ��ţ��ȳ�����Ksp[Fe��OH��3]Ksp[Mg��OH��2]���������=����������Ҫʹ0.2mol/L����ͭ��Һ��ͭ���ӳ�����Ϊ��ȫ��ʹͭ����Ũ�Ƚ���ԭ����ǧ��֮һ������Ӧ����Һ���������������Һʹ��ҺpHΪ �� �� Ksp[Cu��OH��2]=2��10��20 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N��Si�Ǻϳ����ͷǽ������ϵ�������ҪԪ�أ���ش�
��1����̬Siԭ�ӵļ۲�����Ų�ͼΪ����2p�ܼ��Ĺ��������չ�������Ƶ���״Ϊ ��
��2��Siԭ�ӿ��γɶ����⻯�����Si2H4��Siԭ�ӵļ۲���Ӷ���ĿΪ �� Siԭ�ӵ��ӻ��������Ϊ ��
��3��N��Si�γɵ�ԭ�Ӿ����У�Nԭ�ӵ���λ��Ϊ ��
��4��NaN3����Ϊ������ȫ���ҵ���������ɫ��ӦΪ��ɫ�����������Ԫ������ɫ��Ӧ����ԭ��Ϊ��N3���ЦҼ��ͦм�����֮��Ϊ �� B��F��N����Ԫ��ͬ���ڣ����ֻ�̬ԭ�ӵĵ�һ�������ɴ�С��˳��Ϊ����Ԫ�ط��ű�ʾ����
��5��NaNO2��һ����Ҫ�Ĺ�ҵԭ�ϣ�NO2���Ŀռ乹��Ϊ ��
��6��SiO2�ľ�������ʯ����ͼ��ʾ�����ƣ����Կ���Siԭ�����Cԭ�Ӻ��������ɼ���Siԭ�Ӽ����1��Oԭ���γɣ� 
�پ�������С�Ļ�������ԭ�ӣ�
���������ܶ�Ϊ��gcm��3 �� ����٤������ΪNA �� ���������������Siԭ�Ӻ�֮��ľ���Ϊpm���ô���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ50mL![]() ��
��![]() �Ļ����Һ�����������
�Ļ����Һ�����������![]() ��Һ��õ�29.02g
��Һ��õ�29.02g
��ɫ�������ù�����ϡ���ᴦ��������������ٵ�9.32g����������ų����Լ��㣺
��1��ԭ�����Һ��![]() �����ʵ���_________
�����ʵ���_________
��2��![]() �����ʵ���Ũ��__________
�����ʵ���Ũ��__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯī�ɶ����������ɣ��ʵ��������������һ��������Ϊ��ʯīϩ����Ӳ�ȳ����˽��ʯ�������˶�����Ҳ�����һ��ĵ��壬���ٴ���֤�ˣ� ��
A.���������ʱ�Ĺ���B.�����غ���ת���Ĺ���
C.��������ԭ��D.�����ӵ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com