
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量,某兴趣小组进行下面实验探究,查阅资料知道:
①2NO + Na2O2=2NaNO2
②2NO2+ Na2O2=2NaNO3
③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+。
Ⅰ.产品制备与检验:用如下装置制备NaNO2:

(1)写出装置A烧瓶中发生反应的化学方程式并标出电子转移的方向和数目________。
(2)B装置的作用是______________________________。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为制备纯净NaNO2应在B、C装置间增加一个装置,请在框内画出增加的装置图,并标明盛放的试剂________。

(4)试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论)________。
Ⅱ.含量的测定
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
(5)第一组实验数据出现异常,造成这种异常的原因可能是________(双项选择)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
D.滴定终了俯视读数
(6)根据表中数据,计算所得固体中亚硝酸钠的质量分数____________________。
(结果保留4位有效数字)
【答案】 将NO2转化为NO,同时Cu与稀硝酸反应生成NO或制取NO
将NO2转化为NO,同时Cu与稀硝酸反应生成NO或制取NO 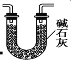 或
或![]() 取少量装置C中产物置于试管中,加入适量蒸馏水溶解,加入稀硫酸酸化,滴加入1~2滴(少量)酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2 A、C 86.25%或0.8625
取少量装置C中产物置于试管中,加入适量蒸馏水溶解,加入稀硫酸酸化,滴加入1~2滴(少量)酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2 A、C 86.25%或0.8625
【解析】
Ⅰ、(1)由装置图可知装置A发生反应为浓硝酸与C的反应,反应中碳元素化合价从0价升高到+4价,失去4个电子,则电子转移可表示为 ;
;
(2)根据实验装置可知,装置C中发生反应:2NO+Na2O2=2NaNO2,则装置B的作用是将NO2转化为NO,同时Cu与稀硝酸反应生成NO(或制取NO);
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,则产生碳酸钠和氢氧化钠的原因是因为NO气体中混有二氧化碳和水蒸气,二者与过氧化钠反应生成碳酸钠和氢氧化钠,故要制备纯净NaNO2应在B、C装置间增加一个装置除去混有的二氧化碳和水蒸气,故应用装有碱石灰的干燥管,装置图为: 或
或![]() ;
;
(4)由题中所给信息③酸性KMnO4溶液可将NO2-氧化为NO3-,MnO4-还原成Mn2+可知欲检验C中NaNO2的存在,需利用酸性高锰酸钾,可设计实验为:取少量装置C中产物置于试管中,加入适量蒸馏水溶解,加入稀硫酸酸化,滴加入1~2滴酸性KMnO4溶液,若溶液紫色褪去,说明C中产物含有NaNO2;
Ⅱ、(5)A、酸式滴定管用蒸馏水洗净后未用标准液润洗,则会导致标准酸性高锰酸钾溶液浓度偏小,则会使所测V(标准)偏大,故A项正确;
B、锥形瓶洗净后未干燥,对实验结果无影响,故B项错误;
C、滴定终了仰视读数,则会导致V(标准)偏大,故C项正确;
D、滴定终了俯视读数,则会导致V(标准)偏小,故D项错误;
本题选AC;
(6)由于第一组数据偏高,应该舍弃;其它三组消耗标准液平均体积为:(20.02+20.00+19.98)mL/3=20.00mL,25mL样品消耗高锰酸钾的物质的量为:0.1000mol/L×0.02L=0.002mol,则250mL样品溶液会消耗高锰酸钾的物质的量为:0.002mol×250Ml/25mL=0.02mol,根据化合价变化可得反应关系式:2MnO4-~5NO2-,则4.000g样品中含有亚硝酸钠的物质的量为:0.02mol×2.5=0.05mol,质量为69g/mol×0.05mol=3.45g,所以反应后的固体中亚硝酸钠的质量分数为:3.45g/4.000g×100%=86.25%。


科目:高中化学 来源: 题型:
【题目】药物中间体Q、医用材料PVA的合成路线如图。
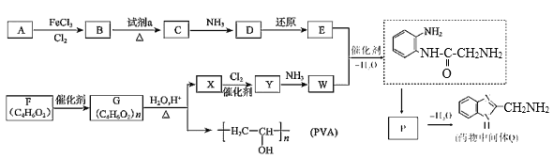
已知:①R-Cl+2NH3→R-NH2+NH4Cl
②R-NO2![]() R-NH2
R-NH2
③-NH2+![]()
(1)A的分子式是________。
(2)B→C是硝化反应,试剂a是________(填名称)。
(3)C→D转化的化学方程式是________。
(4)E的结构简式是________。
(5)F含有的官能团是________(填名称),与其含有相同官能团的同分异构体还有________种。
(6)G→X的化学方程式是________。
(7)W能发生缩聚反应,形成的高分子结构简式是________。
(8)P的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 将过量的氨水加入到CuSO4溶液中,最终得到蓝色沉淀
B. 由于氢键的作用,H2O的稳定性强于H2S
C. 在核电荷数为26的元素原子核外价电子排布图为![]()
D. 核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物有许多用途,回答下列问题:
(1)基态Si原子价层电子的排布图(轨道表达式)为_________,含有长硅链的化合物不是氢化物,而是氯化物。主要原因是F比H多了一种形状的原子轨道,该原子轨道的形状为___________。
(2)SiF4分子的立体构型为_______形,SiCl4的熔、沸点均高于SiF4,主要原因是________________。
(3)SiF4可KF反应得K2SiF6晶体,该晶体可用于制取高纯硅,K2SiF6晶体中微观粒子之间的作用力有______。
a.离子键 b.共价键 c.配位键 d.分子间作用力 e.氢键

(4)H4SiO4的结构简式如图(1),中心原子Si的轨道杂化类型为_________,H4SiO4在常温下能稳定存在,但H4CO4不能,会迅速脱水生成H2CO3,最终生成CO2,主要原因是___________。
(5)硅的晶胞结构如图(2)所示,若该立方晶胞的边长为a nm,阿伏伽德罗常数的数值为NA,则距离最近的两个硅原子间的距离为_____nm,晶体硅密度的计算表达式为_____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组用如图装置![]() 铁架台等仪器略
铁架台等仪器略![]() 探究氧化铁与乙醇的反应,并检验反应产物。
探究氧化铁与乙醇的反应,并检验反应产物。
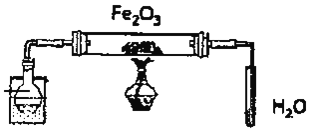
已知:![]() 乙醇的氧化产物是乙醛;
乙醇的氧化产物是乙醛;
![]() 乙醇和乙醛都易溶于水,乙醇沸点是75℃ ,是20.8℃
乙醇和乙醛都易溶于水,乙醇沸点是75℃ ,是20.8℃
(1)组装好仪器后须进行的操作是______,其方法是______
(2)圆底烧瓶中试剂的结构简式是______。
(3)本实验装置有一处不合理,如不加以改进可能会发生______。
(4)经上述实验,观察至红色的Fe2O3全部变为黑色固体。停止加热,冷却后取出硬质玻璃管中的黑色固体少许许于试管中,再加入足量稀硫酸,振荡,固体全部溶解,得到澄清溶液,实验过程中未观察到气泡产生。澄清溶液中一定含有的金属阳离子是______检验该离子的实验是______
(5)黑色固体成分用FeOx示。用下列装置测量X值。
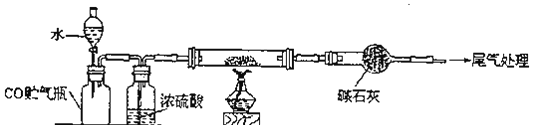
![]() 充分反应后,停止实验的操作是_______
充分反应后,停止实验的操作是_______
![]() 实验中测得数据如下
实验中测得数据如下![]() 进行的反应己完全
进行的反应己完全![]() :
:
空硬质玻璃管的质量56.0g
硬质玻璃管和FeOx的总质量79.2g
硬质玻璃管和Fe粉的总质量72.8g(冷却到室温称量![]()
反应前干燥管及内盛物的总质量48.0g
反应后干燥管及内盛物的总质量65.6g
据上述数据计算出X=______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气的脱硫脱硝是目前研究的热点。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJmol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJmol-1
③H2O(g)=H2O(l) △H=-44 kJmol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l) 的热化学方程式_________。
(2)某科研小组研究臭氧氧化--碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+ O3(g) NO2(g)+O2(g) △H1= -200.9 kJmol-1Ea1= 3.2 kJmol-1
反应Ⅱ:SO2(g)+ O3(g) SO3(g)+O2(g)△H2= -241.6 kJmol-1 Ea2= 58 kJmol-1
已知该体系中臭氧发生分解反应:2O3(g) 3O2(g)。请回答:
其它条件不变,每次向容积为2L的反应器中充入含1.0 mol NO、1.0 mol SO2的模拟烟气和2.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:
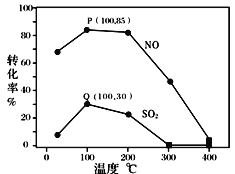
①由图可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______。
②下列说法正确的是 ____________ 。
A.P点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若缩小反应器的容积可提高NO和SO2的转化率
③假设100℃时P(NO转化率为85%)、Q(SO2转化率为30%)均为平衡点,此时反应时间为10分钟,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是_______mol;NO的平均反应速率为_______________;反应Ⅱ在此时的平衡常数为_______________ 。
(3)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能:
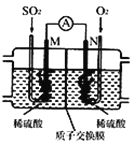
①M极发生的电极反应式为 ____________。
②当外电路通过0.2 mol电子时,质子交换膜左侧的溶液质量_____(填“增大”或“减小”)_______克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.Cl2通入水中:Cl2+H2O=2H++Cl-+ClO-
B.向FeCl3溶液中加入铁粉:Fe3++Fe=2Fe2+
C.向澄清石灰水中通入CO2:2OH-+CO2=CO32-+H2O
D.向稀HNO3溶液中加入少量铜粉:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)材料是人类赖以生存的物质基础。
①制造水泥、玻璃都要用到的原料是___(填字母)。
a.石灰石 b.纯碱 c.黏土
②不锈钢丝与棉纤维可织成一种防辐射布料。这种布料属于___(填字母)。
a.合金材料 b.复合材料 c.陶瓷材料
③橡胶可用于制造轮胎,天然橡胶通过___(填字母)措施可增大强度和弹性。
a.硝化 b.氧化 c.硫化
(2)环境保护功在当代、利在千秋。
①燃煤中加入碳酸钙,可减少SO2的排放。表示该反应原理的化学方程式为___。
②治理废水中的重金属污染物可用沉淀法。往含铬(Cr3+)废水中加入石灰乳使Cr3+转变为___(填化学式)沉淀而除去。
③将CO2和H2按物质的量1∶4混合,在Ru/TiO2作催化剂、加热条件下反应可获得CH4。写出该反应的化学方程式:___。
(3)合理选择饮食,有益身体健康。某同学在食堂的午餐是:米饭、红烧肉、西红柿炒鸡蛋和一只苹果。
①其中主要为人体提供能量的食物是___。该食物中的主要成分在人体内完全水解的化学方程式为___。
②西红柿中富含维生素C,西红柿生吃比炒熟后吃维生素C的利用率高,原因是___。用淀粉溶液和碘水检验维生素C的还原性,有关实验操作和现象是___。
③苹果中含有一定量的铁元素,人体缺铁会导致的疾病是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥运吉祥物“福娃”外材为纯羊毛线,内充物为无毒的聚酯纤维,该聚酯纤维的结构简式为 ,下列说法正确的是
,下列说法正确的是
A. 羊毛与该聚酯纤维的化学成分相同
B. 该聚酯纤维和羊毛在一定条件下均不能水解
C. 由单体合成该聚酯纤维的反应属于加聚反应
D. 合成该聚酯纤维的单体为对苯二甲酸和乙二醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com