
����Ŀ���輰�仯������������;���ش��������⣺
(1)��̬Siԭ�Ӽ۲���ӵ��Ų�ͼ���������ʽ��Ϊ_________�����г������Ļ����ﲻ���⻯������Ȼ����Ҫԭ����F��H����һ����״��ԭ�ӹ������ԭ�ӹ������״Ϊ___________��
(2)SiF4���ӵ����幹��Ϊ_______�Σ�SiCl4���ۡ��е������SiF4����Ҫԭ����________________��
(3)SiF4��KF��Ӧ��K2SiF6���壬�þ����������ȡ�ߴ��裬K2SiF6������������֮�����������______��
a.���Ӽ� b.���ۼ� c.��λ�� d.���Ӽ������� e.���

(4)H4SiO4�Ľṹ��ʽ��ͼ(1)������ԭ��Si�Ĺ���ӻ�����Ϊ_________��H4SiO4�ڳ��������ȶ����ڣ���H4CO4���ܣ���Ѹ����ˮ����H2CO3����������CO2����Ҫԭ����___________��
(5)��ľ����ṹ��ͼ(2)��ʾ���������������ı߳�Ϊa nm������٤����������ֵΪNA������������������ԭ�Ӽ�ľ���Ϊ_____nm��������ܶȵļ������ʽΪ_____g/cm3��
���𰸡�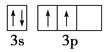 ������ �������� SiCl4�ĵ���Է�����������SiF4�����Ӽ����������� abc sp3�ӻ� Si��ԭ�Ӱ뾶����C
������ �������� SiCl4�ĵ���Է�����������SiF4�����Ӽ����������� abc sp3�ӻ� Si��ԭ�Ӱ뾶����C ![]()
![]()
��������
(1)���ݹ���ԭ����Ϻ��ع�����дSi�Ĺ������ʽ�����F��Hԭ�Ӻ�������Ų�ʽ��������������ƵĿռ���״�жϣ�
(2)���ݼ۲���Ӷ����жϿռ���״�����ݷ��Ӽ�����������Է��������Ĺ�ϵ�����Ƚϣ�
(3) K2SiF6����Ϊ���Ӿ��壬������ӵĽṹ������
(4)H4SiO4�е�Siԭ�����������Ų�Ϊ3s23p2��ȫ�γɹ��ۼ���Ϊsp3�ӻ���ͬһ�����Ԫ���γɻ�����ṹ���ƣ���ԭ�Ӱ뾶��С��ͬ���Ӷ��ߵIJ�ͬ������
(5)���������Siԭ�Ӵ��ھ����Խ��ߵ�![]() �����þ�̯������һ�������к��е�Si��ԭ�Ӹ�����Ȼ�������ܶȹ�ʽ�����ܶȴ�С��
�����þ�̯������һ�������к��е�Si��ԭ�Ӹ�����Ȼ�������ܶȹ�ʽ�����ܶȴ�С��
(1)Si��14��Ԫ�أ����ݹ���ԭ����֪�����������Ų�ʽΪ1s22s22p63s23p2����Ϻ��ع����֪Siԭ�ӵļ۲���ӵ��Ų�ͼΪ ��F��9��Ԫ�أ���������Ų�ʽΪ��1s22s22p5��H����ֻ��1�����ӣ������Ų�ʽΪ1s1���ɼ����ߵ���������Fԭ�Ӻ�����p���ӣ�p���Ϊ�����Σ�
��F��9��Ԫ�أ���������Ų�ʽΪ��1s22s22p5��H����ֻ��1�����ӣ������Ų�ʽΪ1s1���ɼ����ߵ���������Fԭ�Ӻ�����p���ӣ�p���Ϊ�����Σ�
(2) SiF4�����е�����ԭ��Si�ļ۲���Ӷ���Ϊ4�����������幹��Ϊ�������壻SiCl4���ۡ��е������SiF4����Ҫԭ���Ƕ��߶��Ƿ��Ӿ��壬�ṹ���ƣ����ڽṹ���Ƶ�������˵����Է�������Խ���Ӽ���������Խ�˷����Ӽ�������ʹ�����ۻ���������Ҫ���������࣬���ʵ��۷е��Խ�ߡ�����SiCl4�ĵ���Է���������SiF4�����Ӽ�����������
(3) K2SiF6����Ϊ���Ӿ��壬������K+��������SiF62-ͨ�����Ӽ���ϣ���������SiF62-������ԭ��Siԭ����6��F�γɹ��ۼ�������2��Ϊ��λ������˺��е�������Ϊ���Ӽ������ۼ�����λ��������ѡ����abc��
(4)H4SiO4�е�Siԭ�����������Ų�Ϊ3s23p2��ȫ�γɹ��ۼ���Ϊsp3�ӻ���C��S���ǵ�IVA��Ԫ�أ�ԭ������㶼��4�����ӣ���Siԭ�ӿ����H4SiO4����CԪ��ֻ���γ�H2CO3��������Si��ԭ�Ӱ뾶����C�����ӶԵ��ų���С����Cԭ�ӵijɼ����Ӷ��ų���ǿ��
(5)��������Ϊa nm�������ĶԽ���Ϊ![]() �����������������Siԭ�Ӵ��ھ����Խ��ߵ�
�����������������Siԭ�Ӵ��ھ����Խ��ߵ�![]() ������˾��������������ԭ�Ӽ�ľ���Ϊ
������˾��������������ԭ�Ӽ�ľ���Ϊ![]() ��
��
��һ�������к��е�Siԭ�Ӹ���Ϊ![]() ��8+
��8+![]() ��6+4=8�������ܶ���=
��6+4=8�������ܶ���=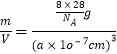 =
=![]() g/cm3��
g/cm3��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������Ӧ��������������ʵ����
|
|
|
|
A����ij��Һ�м���������������ټ�BaCl2������ɫ����֤����SO42- | B����Ʒ�м�NaOH��Һ���ȣ���ɫʯ����ֽ��죬֤��������Ʒ����NH4+�Ĵ��� | C�������������Ȼ��ص�����ر�����Һ�ڱ�ˮ����ȴ��KNO3���������� | D�������ȵ�ͭ˿����ʢ�������ļ���ƿ�У�ͭ˿����ȼ�գ������ػ�ɫ���� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ��CH3COOH�ĵ���ƽ�ⳣ��ΪK����20mL 0.1mol/L CH3COOH��Һ����μ���0.1mol/L NaOH��Һ����pH�仯������ͼ��ʾ�������¶ȱ仯��������˵������ȷ���ǣ� ��
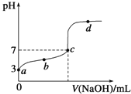
A. b���ʾ����Һ��c(Na+)��c(CH3COO��)
B. c���ʾCH3COOH��NaOHǡ�÷�Ӧ��ȫ
C. d���ʾ����Һ��c(CH3COO��) c(H+)/c(CH3COOH)����K
D. b��c��d�����ʾ����Һ��һ�������ڣ�c(Na+)+c(H+)�Tc(CH3COO��)+c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾԭ���װ�õ���������ȷ����
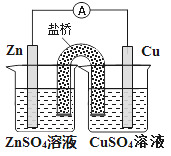
A. ͭ��������ͭƬ�������ݲ���
B. пƬ��������
C. ���Ӵ�ͭƬ����������пƬ
D. ��������������ZnSO4��Һ�ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���е�NO��CO�������·�Ӧ2NO(g)��2CO(g) ![]() N2(g)��2CO2(g)����H��0������˵���д������
N2(g)��2CO2(g)����H��0������˵���д������
A. �÷�Ӧ�з�Ӧ��������������������������
B. �����¶ȣ�����Ӧ���ʼӿ죬�淴Ӧ���ʼ���
C. �����¶ȣ�NOת���ʼ�С
D. ʹ�ú��ʵĴ�����������Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʾ���ʵ��Ʊ�������������
A. ʵ���ҴӺ�������ȡ���ʵ�ȡ�����������ܽ�����������ȡ������
B. ���ʯ(��Ҫ�ɷ�TiO2)Ϊԭ����������Ti�����ʯ����̿![]() TiCl4
TiCl4![]() Ti
Ti
C. ��±ˮ��(������Ҫ��MgCl2)��ȡMg
±ˮ![]() Mg(OH)2
Mg(OH)2![]() MgCl2(aq)
MgCl2(aq) ![]() MgCl(s)
MgCl(s) ![]() Mg
Mg
D. ��ʳ����ȡƯ�۾�NaCl(ag) ![]() Cl2
Cl2![]() Ư�۾�
Ư�۾�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25���²�������ĵ��볣������������й�˵������ȷ����

A. �� HCOONa�� HCOOH�Ļ����Һ��pH=3����c( HCOOH)/c(HCOO��)=10
B. ��ͬpH�� HCOONa��NaClO��Һ��������Ũ��ǰ�ߴ�
C. ��Ũ�ȵ������Na2S�� HCOOH��Ϻ�c(Na+)=2c(HCOO��)+2c( HCOOH)
D. ��NaClO��Һ��ͨ��H2S�����ķ�ӦΪClO��+H2S![]() HS��+HClO
HS��+HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���п�Ժһ�����³ɹ�ʵ���˼����Ч������ϩ�������ڴ�����������,������ �о����ɻ�ż����Ӧ������ϩ���䷴Ӧ���£�2CH4(g) ![]() C2H4(g) +2H2(g) ��H>0
C2H4(g) +2H2(g) ��H>0
��ѧ�� | H��H | C��H | C = C | C��C |
E(kJ / mol) | a | b | c | d |
(1)��֪��ػ�ѧ���ļ������ϱ��������Ʊ���ϩ��Ӧ����H=_____________ (�ú�a.b.c.d�Ĵ���ʽ��ʾ)��

(1)T1�¶�ʱ����1 L�ĺ��ݷ�Ӧ���г���2 molCH4 ,������������Ӧ����Ӧ������ 0~15 min CH4�����ʵ�����ʱ��仯��ͼ,���10-15 minʱH2��Ũ��Ϊ1.6 mol/L��
��0~ 10 min��CH4��ʾ�ķ�Ӧ����Ϊ____mol/(Lmin) o
����ͼ������a������b�ֱ��ʾ���¶�T1ʱ��ʹ��������ͬ���������ͬ�Ĵ��� ʱ���ﵽƽ�������n (CH4)�仯���ߣ����б�ʾ����������ϴ�������� ________ (��"a"�� ��b��)��
��15 minʱ,���ı���練Ӧ����,����n( CH4)����ͼ����ʾ�仯����ı������������_____(�δ�һ������)��
(3)ʵ����v��=k��c2(CH4),v��=k��c(C2H4).c2(H2) ����K����K��Ϊ���ʳ��������¶��йأ�T1�¶�ʱk����K���ı�ֵΪ______ (����ֵ)�������¶���T1���ߵ�T2,��Ӧ��������ı���V�� ____V��(ѡ������������=����<��)���жϵ�������__________
(4)������Ա����˼���ȼ�ϵ�ز����ڵ�⡣��ͼ��ʾ��������Dz����� Y2O3�� ZrO2�Ĺ��壬���ڸ����´���O2-
��C����PtΪ_______ ��(ѡ���������������� )��
�ڸõ�ع���ʱ������Ӧ����ʽΪ_____________________ ��
���øõ�ص�ⱥ��ʳ��ˮ��һ��ʱ����ռ�����������������Ϊ112 mL,��������������Һ��25 0CʱpH=_______ (������ǰ��NaCl��Һ�������Ϊ500 mL)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1000mol/L��NaOH��Һ�ζ�ijŨ�ȵĶ�Ԫ����(![]() )��Һ��������Һ�и��ֺ�X���������ʵ�������(
)��Һ��������Һ�и��ֺ�X���������ʵ�������(![]() )��pH�ı仯������ͼ��ʾ������˵����ȷ����
)��pH�ı仯������ͼ��ʾ������˵����ȷ����

A. ![]() �ĵ��볣��
�ĵ��볣��![]() ��
�� ![]() ��ˮ�ⳣ��
��ˮ�ⳣ��![]()
B. ��ˮ�������c(![]() )��a>b
)��a>b
C. ����![]() �ֱ��ʾ
�ֱ��ʾ![]() (
(![]() )��
)��![]() (HX-)�ı仯
(HX-)�ı仯
D. b����ʾ��Һ�У�c(![]() >3c(
>3c(![]() )
)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com