
【题目】汽车尾气中的NO与CO发生如下反应2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) ΔH<0,下列说法中错误的是
N2(g)+2CO2(g) ΔH<0,下列说法中错误的是
A. 该反应中反应物的总能量高于生成物的总能量
B. 升高温度,正反应速率加快,逆反应速率减慢
C. 升高温度,NO转化率减小
D. 使用合适的催化剂,能增大反应速率
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据热化学方程式N2(g)+3H2(g)![]() 2NH3(g)+92kJ,下列有关图像和叙述中正确的是
2NH3(g)+92kJ,下列有关图像和叙述中正确的是
A.  B.
B. 
C. 向密闭容器中通入1mol氮气和3mol氢气发生反应放出92kJ的热量D. 形成1mol氮氮键和3mol氢氢键所放出的能量比拆开6mol氮氢键所吸收的能量多92kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦炭是重要的工业原材料。
(1)已知在一定温度下,C(s)+CO2(g) ![]() 2CO(g) 平衡常数K1;C(s)+H2O(g)
2CO(g) 平衡常数K1;C(s)+H2O(g) ![]() CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g)
CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g) ![]() H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
(2)用焦炭还原NO的反应为:2NO(g)+ C(s)![]() N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_____________ ;
②该反应的平衡常数表达式为__________________;400℃,该反应的平衡常数为_______;
③乙容器的反应温度T____400 ℃(填“>”“<”或“=”)
④丙容器达到平衡时,NO的转化率为___________;平衡时CO2的浓度为________。
⑤在恒容密闭容器中加入焦炭并充入NO气体,下列图像正确且能说明反应达到平衡状态的是___。
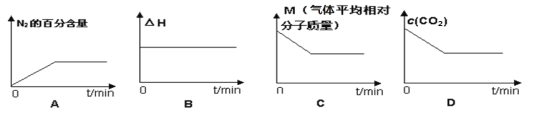
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol/L醋酸溶液中存在电离平衡CH3COOH ![]() CH3COO-+H+,要使溶液中c(H+)增大,可以采取的措施
CH3COO-+H+,要使溶液中c(H+)增大,可以采取的措施
A. 升高温度 B. 加少量烧碱溶液 C. 加CH3COONa固体 D. 加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物有许多用途,回答下列问题:
(1)基态Si原子价层电子的排布图(轨道表达式)为_________,含有长硅链的化合物不是氢化物,而是氯化物。主要原因是F比H多了一种形状的原子轨道,该原子轨道的形状为___________。
(2)SiF4分子的立体构型为_______形,SiCl4的熔、沸点均高于SiF4,主要原因是________________。
(3)SiF4可KF反应得K2SiF6晶体,该晶体可用于制取高纯硅,K2SiF6晶体中微观粒子之间的作用力有______。
a.离子键 b.共价键 c.配位键 d.分子间作用力 e.氢键

(4)H4SiO4的结构简式如图(1),中心原子Si的轨道杂化类型为_________,H4SiO4在常温下能稳定存在,但H4CO4不能,会迅速脱水生成H2CO3,最终生成CO2,主要原因是___________。
(5)硅的晶胞结构如图(2)所示,若该立方晶胞的边长为a nm,阿伏伽德罗常数的数值为NA,则距离最近的两个硅原子间的距离为_____nm,晶体硅密度的计算表达式为_____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。其中,甲池为3mol·L-1的AgNO3溶液,乙池为1mol·L-1的AgNO3溶液A、B均为Ag电极。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法不正确的是

A. 当电流计指针归零后,断开K2,闭合K1,一段时间后B电极的质量增加
B. 断开K1,闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等
C. 实验开始先断开K1,闭合K2,此时NO3-向B电极移动
D. 当电流计指针归零后,断开K2闭合K1,乙池溶液浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L · s)]与反应时间t(s)的关系如图所示。该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4==K2SO4+2MnSO4+10CO2↑+8H2O
回答如下问题:

(1)0→t2时间段内反应速率增大的原因是: _________________________________ ,
(2)t2→t时间段内反应速率减小的原因是: _______________ ,
(3)图中阴影部分“面积”表示t1→t3时间里________ 。
A.Mn2+物质的量浓度的增大 B.Mn2+物质的量的增加
C.SO42-物质的量浓度 D.MnO4-物质的量浓度的减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L![]() 中含有的极性键数目为0.2
中含有的极性键数目为0.2![]()
B. 13.8g![]() 和
和![]() 的混合气体与足量水反应,转移的电子数为0.2
的混合气体与足量水反应,转移的电子数为0.2![]()
C. 足量铜与含0.2mol![]() 的浓硫酸反应,生成
的浓硫酸反应,生成![]() 分子数为0.1
分子数为0.1![]()
D. 常温下,pH均为4的![]() 溶液和
溶液和![]() 溶液各1L,水电离出的
溶液各1L,水电离出的![]() 数目均为
数目均为![]()
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com