
【题目】在一定温度下,将气体 X和气体Y各0.16mol充入 10L恒容密闭容器中,发生反应: X(g) + Y(g) 2Z(g) △ H < 0.一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是( )

A.反应前 2 min 的平均速率v(Z) > 2.0 × 103 mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前:v(逆) > v(正)
C.保持其他条件不变,起始时向容器中充入0.32 mol气体 X和0.32 mol气体Y,到达平衡时,c(Z) > 0.24 mol·L-1
D.该温度下此反应的平衡常数:K = 1.44
【答案】D
【解析】
A选项,反应前 2 min 内Y的改变量为0.04mol,则Z改变量为0.02mol,2min内Z的平均速率![]() ,故A错误;
,故A错误;
B选项,其他条件不变,降低温度,平衡向放热方向移动,正向移动,反应达到新平衡前:v(正) > v(逆),故B错误;
C选项,充入气体 X和气体Y各0.16mol,平衡时Y的物质的的量为0.10mol,则改变量为0.06mol,此时Z的物质的量为0.12mol,浓度为0.012molL-1,保持其他条件不变向容器中充入0.32 mol气体 X和0.32 mol气体Y,用建模思想,相当于两个容器,缩小容器加压,平衡不移动,浓度为原来2倍,即c(Z) = 0.024 mol·L-1,故C错误;
D选项,平衡时,Y的物质的量为0.1mol,X的物质的量为0.1mol,Z的物质的量为0.12mol,该温度下此反应的平衡常数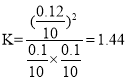 ,故D正确。
,故D正确。
综上所述,答案为D。


科目:高中化学 来源: 题型:
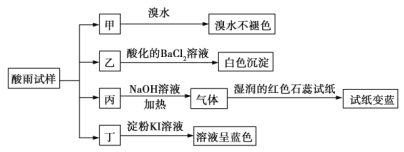
【题目】某地环保部门将收集到的一定量酸雨试样分成甲、乙、丙、丁四份,进行如图所示的实验探究。
已知酸雨试样中可能含有下表所示的某些离子:
阳离子 |
|
阴离子 |
|
请回答下列问题:
(1)![]() 是______,
是______,![]() 是______。
是______。
(2)可能存在的阴离子是______,能证明该阴离子是否存在的简单实验操作为______。
(3)写出丁试样中滴加淀粉![]() 溶液所发生反应的离子方程式:______。
溶液所发生反应的离子方程式:______。
(4)某次降雨收集到![]() 雨水,向雨水中滴加
雨水,向雨水中滴加![]() 的
的![]() 溶液,充分反应后测得溶液中
溶液,充分反应后测得溶液中![]() ,再向该溶液中加入足量的
,再向该溶液中加入足量的![]() 溶液,经过滤、蒸干、称重,测得沉淀的质量为
溶液,经过滤、蒸干、称重,测得沉淀的质量为![]() 。假设雨水的酸性仅由
。假设雨水的酸性仅由![]() 和
和![]() 的排放所致,则排放到空气中的
的排放所致,则排放到空气中的![]() 和
和![]() 的物质的量之比约为______(不考虑
的物质的量之比约为______(不考虑![]() 的相互反应)。
的相互反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用废铁屑制备磁性胶体粒子,制取过程如下:

下列说法不正确的是
A. 用Na2CO3溶液浸泡是为了除去废铁屑表面的油污
B. 通入N2是防止空气中的O2氧化二价铁元素
C. 加适量的H2O2是为了将部分Fe2+氧化为Fe3+,涉及反应:H2O2+2Fe2++2H+=2Fe3++2 H2O
D. 溶液A中Fe2+和Fe3+的浓度比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列说法错误的是
A.l00g质量分数为46%的乙醇水溶液中氧原子数为4NA
B.向FeI2溶液中通人适量Cl2,当有1mol Fe2+被氧化时,反应转移电子数目为3NA
C.某温度下,1L pH=2的H2SO4溶液中,硫酸和水电离出的H+总数为0.01NA
D.常温下,1L 0.1mol·L1醋酸钠溶液中加入醋酸至中性,则溶液中CH3COO-数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
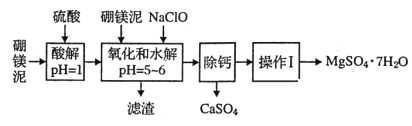
(1)实验中需用1mol/L的硫酸480mL,若用18.4mol/L的浓硫酸来配置,量取浓硫酸时需使用的量筒规格为(_______)。
A 10mL B 20mL C 50mL D 100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-还有一种离子也会被NaClO氧化,该反应的离子方程式为___________________________;滤渣中除含有氢氧化铁、氢氧化铝外还有_________。
(3)在“除钙”前需检验滤液中Fe3+是否被除尽,简述检验方法_____________________。
(4)已知硫酸镁、硫酸钙的溶解度如下表
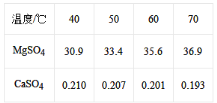
“除钙”是将;硫酸镁和硫酸钙混合溶液中的硫酸钙除去根据上表数据,采取的操作是_______________、趁热过滤、_________、____________,便得到比较纯净的硫酸镁。
(5)实验中提供的硼镁泥共100g,得到的MgSO4·7H2O为172.2g,则MgSO4·7H2O的产率为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某1L待测溶液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
现进行如下实验操作(每次实验所加试剂均过量)
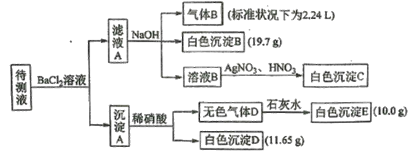
下列说法不正确的是
A.向溶液B中加AgNO3与HNO3的操作是多余的,待测液中一定含有的离子是K+、NH4+、CO32-、HCO3-、且c(K+)≥0.1mol·L-1
B.生成白色沉淀B的离子方程式为Ba2++HCO3-+OH-=BaCO3↓+H2O
C.已知白色沉淀C能溶于浓氨水,离子方程式为AgCl+2NH3·H2O=Ag(NH3)2++Cl-+2H2O
D.若无色气体D是混合气体,则沉淀A的成分可能是BaCO3、BaSO3、BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NOx等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)已知 4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol1
①该反应在________________(填“高温、低温或任何温度”)下能自发进行。
②对于该反应,改变某一反应条件(温度T1>T2),下列图象正确的是_______(填序号)。
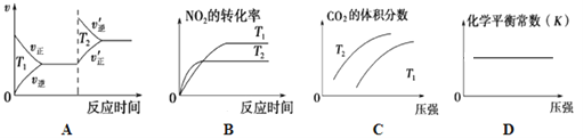
③某实验小组模拟上述净化过程,一定温度下,在2L的恒容密闭容器中,起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中CO的转化率为50%,则该反应的平衡常数为__________;两种方式达平衡时,N2的体积分数:甲______乙( 填“>、=、<或不确定”,下同),NO2的浓度:甲______乙。

(2)柴油汽车尾气中的碳烟(C)和NOx可通过某含钴催化剂催化消除。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂测得所有产物(CO2、N2、N2O)与NO的相关数据结果如图所示。
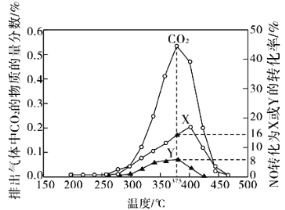
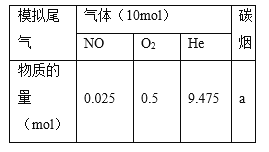
①375℃时,测得排出的气体中含0.45 mol O2和0.0525 mol CO2,则Y的化学式为________。
②实验过程中采用NO模拟NOx,而不采用NO2的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是

A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性
B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2
C.反应③④⑤均属于氧化还原反应
D.工业上可利用反应②和反应④回收SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com