
【题目】(1)写出符合以下离子方程式的化学方程式:Ba2++SO42-=BaSO4↓________________;
(2)用文字解释明矾净水的原因:______________________________________________;
(3)根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
①用单线桥表示出该反应电子转移的数目和方向_______________________;
②氧化剂是_____________;
③当有34gNH3参加反应时,被氧化的物质的质量为_____g,生成的还原产物的质量为____g。
【答案】BaCl2+ H2SO4= BaSO4↓+2HCl(答案合理即可) 明矾与水反应生成有强吸附性的Al(OH)3胶体 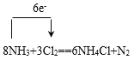 Cl2 8.5 80.25
Cl2 8.5 80.25
【解析】
根据离子方程式的书写规则分析解答;用双线桥法分析氧化还原反应。
(1)书写离子方程式时,强酸、强碱和可溶性盐要写成离子形式,所以符合Ba2++SO42-=BaSO4↓的化学方程式是: BaCl2+ H2SO4= BaSO4↓+2HCl;
(2)明矾与水反应生成有强吸附性的Al(OH)3胶体;
(3)①单线桥可以表示电子转移的数目和方向,从失电子的元素指向得电子的元素: ;
;
②元素化合价降低的反应物是氧化剂,故答案为:Cl2;
③由方程式得,8mol氨气参加反应,2mol氨气被氧化,还原产物为6mol氯化铵,m(NH3)=34g![]() =8.5g;m(NH4Cl)=53.5g/mol
=8.5g;m(NH4Cl)=53.5g/mol![]() =80.25g,故答案为: 8.5;80.25。
=80.25g,故答案为: 8.5;80.25。


科目:高中化学 来源: 题型:
【题目】下列实验是化学中的基础实验,请回答有关问题。
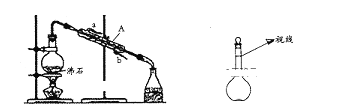
(1)用四氯化碳提取溴水中的溴,所用的分离方法是______,用到的主要仪器是______________,
(2)用图装置分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有_____,实验时仪器A中冷却水的进口为_______________(选填“a”或“b)
(3)实验室需配制100mL 3.6mol·L—1的稀硫酸。若采用18 mol·L—1的浓硫酸来配制稀硫酸需要用到浓硫酸的体积为_____________,实验中将溶液转移到容量瓶中的正确操作是_________________________。在稀硫酸配制过程中,某同学观察液面的情况如图所示,所配稀硫酸的浓度会____________(填“偏高”“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al、Mg及其化合物在生产、生活中有着广泛的应用,请按要求回答下列问题。
I. 用废铝渣制备Al(OH)3的流程如下图所示,假设反应①杂质不反应。

(1)Al在元素周期表中的位置为______,试剂X的名称______ 。
(2)溶液A显酸性的原因可能是(可用离子方程式表示) a.盐酸过量;b. ____________。
II.用镁硅酸盐矿石制备高纯度Mg(OH)2的流程如下图所示:
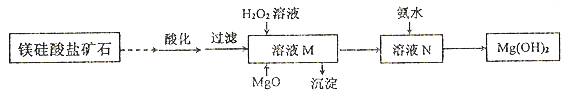
已知:①溶液M中除含Mg2+、SO42-外,还含少量Fe3+、 Al3+、Fe2+等离子;
②Mg2+与氨水的反应为吸热反应。
(1)向溶液M中先加入的试剂是_______;产生的沉淀有_____。H2O2参与反应的离子方程式是____________________。
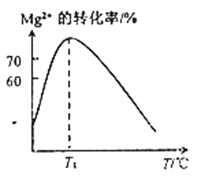
(2)溶液N中Mg2+的装化率随温度T的变化情况如图所示。T1之后,Mg,2+的转化率减小的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于天然物质水解的叙述正确的是
A. 油脂的水解反应都是皂化反应B. 蛋白质水解的最终产物均为葡萄糖
C. 油脂的水解可得到甘油D. 淀粉水解和纤维素水解得到的最终产物不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种仪器:①漏斗;②容量瓶;③温度计;④分液漏斗;⑤天平;⑥量筒;⑦胶头滴管;⑧蒸馏烧瓶。常用于物质分离的是( )
A.①③⑦B.②⑥⑦
C.①④⑧D.④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供艇员呼吸之用,它与二氧化碳反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2。某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2,设计出如下实验装置:
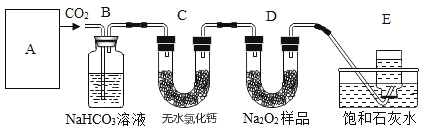
(1)A中制取CO2的装置,应为下列图①、②、③中的图____________;
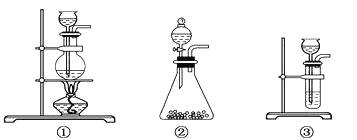
B装置的作用是________,为了检验E中收集到的气体,在取出集气瓶后,_____________;
(2)若E中的石灰水出现轻微白色浑浊,请说明原因:_________________;
(3)反应完毕时,若测得E中的集气瓶收集到的气体为250 mL,又知氧气的密度为1.43 g/L,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值________(填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》记载:“烧酒,其法用浓酒和糟入甑,蒸令气上,用器承滴露”,“凡酸坏之酒,皆可蒸烧”。这里用到的实验方法可以用于分离()。
A. 甲苯与水 B. 乙醇与水 C. 碘与水 D. 硝酸钾与氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100mol/L盐酸分别滴定10.00mL浓度均为0.100mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温下Kb=1.6×10-4)。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法错误的是
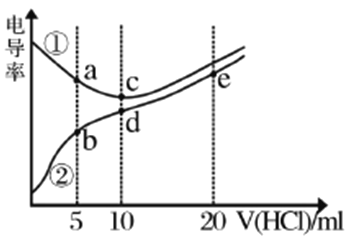
A. a、d、e三点的溶液中,水的电离程度最大的是d点
B. 溶液温度c点高于d点
C. b点溶液中:c[(CH3)2NH2+]+c[(CH3)2NH·H2O]=2c(Cl-)
D. d点溶液中:c(H+)+ c[(CH3)2NH·H2O]=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理的发展在化学的发展史上有重要的推动作用。
(1)下图为N2和O2生成NO时的能量变化情况。

则NO分解为N2和O2的反应是 (填“吸热”或“放热”)反应。
(2)在某体积为2L的密闭容器中充入0.5molNO2和1molCO,一定条件下发生反应:
NO2(g)+ CO(g) ![]() CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.2mol。
CO2(g)+NO(g),2min时,测得容器中NO的物质的量为0.2mol。
①该段时间内,用CO2表示的平均反应率为 。
②下列事实能说明此反应在该条件下已经达到化学平衡的是 (填序号)。
A.容器内气体总质量保持不变 B.NO2的物质的量浓度不再改变
C.NO2的消耗速率与CO2的消耗速率相等 D.容器内气体总物质的量保持不变
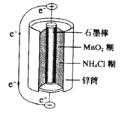
(3)锌锰干电池是最早使用的化学电池,其基本构造如下图所示。电路中每通过0.4mol电子,负极质量减少 g;工作时NH4+在正极放电产生两种气体,其中一种气体分子是含10电子的微粒,正极的电极反应式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com