
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用氯酸钠(NaClO3)为原料制取,(常温下ClO2为气态),下列说法错误的是
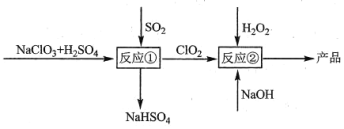
A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B.反应①后生成的气体要净化后进入反应②装置
C.升高温度,有利于反应②提高产率
D.反应②中有气体生成
科目:高中化学 来源: 题型:
【题目】以环己醇为原料制取己二酸[HOOC(CH2)4COO H]的实验流程如下:
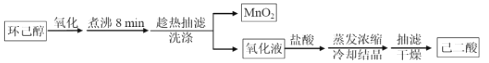
其中“氧化”的实验过程:在250mL四颈烧瓶中加入50 mL水和3.18g碳酸钠,低速搅拌至碳酸钠溶解,缓慢加入9.48g(约0.060 mol)高锰酸钾,按图示搭好装置:
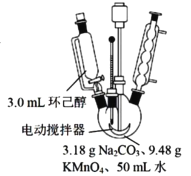
打开电动搅拌,加热至35℃,滴加3.2 mL(约 0.031 mol) 环己醇,发生的主要反应为:![]()
![]() KOOC(CH2)4COOK H<0
KOOC(CH2)4COOK H<0
(1)“氧化”过程应采用____________加热
(2)“氧化”过程为保证产品纯度需要控制环己醇滴速的原因是:_______________。
(3)为证明“氧化”反应已结束,在滤纸上点1滴混合物,若观察到___________则表明反应已经完成。
(4)“趁热抽滤”后,用___________进行洗涤(填“热水”或“冷水")。
(5)室温下,相关物质溶解度如表:
化学式 | 己二酸 | NaCl | KCl |
溶解度g/100g水 | 1.44 | 35.1 | 33.3 |
“蒸发浓缩”过程中,为保证产品纯度及产量,应浓缩溶液体积至_________(填标号)
A.5mL B.10mL C.15mL D.20mL
(6)称取己二酸(Mr-=146 g/mol)样品0.2920 g,用新煮沸的50 mL 热水溶解,滴入2滴酚酞试液,用0.2000 mol/L NaOH 溶液滴定至终点,消耗 NaOH 的平均体积为 19.70 mL。NaOH 溶液应装于____________(填仪器名称),己二酸样品的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电反应方程式为4Na+3CO2 =2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示,下列说法中错误的是( )
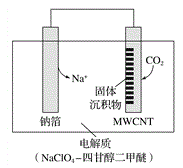
A. 电流流向为:MWCNT→导线→钠箔
B. 放电时,正极的电极反应式为 3CO2+4Na++4e-===2Na2CO3+C
C. 原两电极质量相等,若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为11.2g
D. 选用髙氯酸钠-四甘醇二甲醚做电解液的优点是导电性好,与金属钠不反应,难挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们利用物质的结构与性质对周期表进行研究,有助于我们更好地掌握同类知识。
(1)基态砷原子中,价电子占用__个原子轨道;雌黄分子式为As2S3,分子结构如图,则砷原子的杂化方式为__。

(2)向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体;该晶体所含的非金属元素中,N、O、S第一电离能由大到小的顺序是__(填元素符号),SO42-的空间构型为__,晶体中含有的化学键有__。加入乙醇后析出[Cu(NH3)4]SO4·H2O晶体的原因是__。
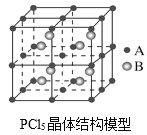
(3)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A微粒与CCl4具有相同的空间构型和相似的化学键特征,则A为__,B为__。
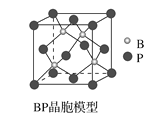
(4)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其立方晶胞。已知晶体中最近的硼原子和磷原子核间距为xcm,磷化硼的摩尔质量为bg·mol-1,阿伏加德罗常数为NA,则磷化硼晶体密度的表达式为__g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠晶体 ![]() 俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿
俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿![]() 主要成份为
主要成份为![]() ,还含有
,还含有![]() 、MgO、
、MgO、![]() 等杂质
等杂质![]() 为主要原料进行生产,其主要工艺流程如下:
为主要原料进行生产,其主要工艺流程如下:
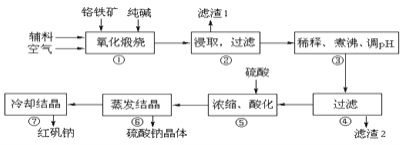
①中涉及的主要反应有:
主反应:![]()
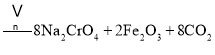
副反应: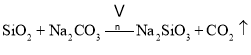 、
、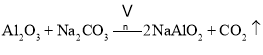
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 |
|
|
|
|
完全沉淀时溶液pH |
|
|
|
|
试回答下列问题:/span>
![]() “①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
![]() “③”中调节pH至
“③”中调节pH至![]() ,目的是 ______ .
,目的是 ______ .
![]() “⑤”中加硫酸酸化的目的是使
“⑤”中加硫酸酸化的目的是使![]() 转化为
转化为![]() ,请写出该平衡转化的离子方程式: ______ .
,请写出该平衡转化的离子方程式: ______ .
![]() 称取重铬酸钠试样
称取重铬酸钠试样![]() 配成250mL溶液,取出
配成250mL溶液,取出![]() 于碘量瓶中,加入10mL
于碘量瓶中,加入10mL![]() 和足量碘化钠
和足量碘化钠![]() 铬的还原产物为
铬的还原产物为![]() ,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用
,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用![]() 标准溶液滴定
标准溶液滴定![]()
①判断达到滴定终点的依据是: ______ ;
②若实验中共用去![]() 标准溶液
标准溶液![]() ,所得产品的中重铬酸钠晶体的纯度
,所得产品的中重铬酸钠晶体的纯度![]() 设整个过程中其它杂质不参与反应
设整个过程中其它杂质不参与反应![]() ______ .
______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2O(l)=2H2(g)+O2(g) △H=+571.0 kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
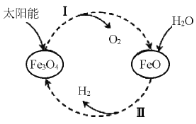
过程I:2Fe3O4(s)=6FeO(s)+O2(g) △H=+313.2 kJ/mol
过程II:……
下列说法不正确的是
A.过程I中每消耗232gFe3O4转移2mol电子:
B.过程II热化学方程式为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+128.9 kJ/mol
C.过程I、II中能量转化的形式依次是:太阳能→化学能→热能
D.过程I中正反应的活化能大于逆反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素-3-羧酸![]() 是一种重要的香料,常用作日常用品或食品的加香剂。
是一种重要的香料,常用作日常用品或食品的加香剂。
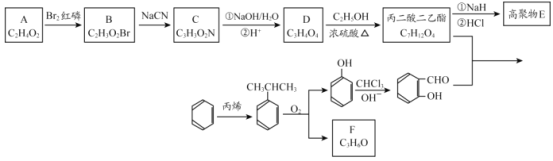
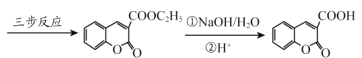
已知:
RCOOR′+ R″OH ![]() RCOOR″ + R′OH(R 代表烃基)
RCOOR″ + R′OH(R 代表烃基)
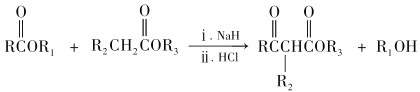
(1)A和B均有酸性,A 的结构简式__________;苯与丙烯反应的类型是_______。
(2)F 为链状结构,且一氯代物只有一种,则F 含有的官能团名称为__________。
(3)D→丙二酸二乙酯的化学方程式:_______。
(4)丙二酸二乙酯在一定条件下可形成聚合物 E,其结构简式为:________。
(5)写出符合下列条件的丙二酸二乙酯同分异构体的结构简式:________。
①与丙二酸二乙酯的官能团相同;
②核磁共振氢谱有三个吸收峰,且峰面积之比为 3:2:1;
③能发生银镜反应。
(6)丙二酸二乙酯与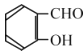 经过三步反应合成
经过三步反应合成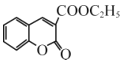 。
。
请写出中间产物的结构简式。
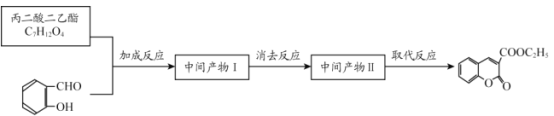
中间产物I__________;中间产物II___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分为BaCuSi4O10,BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均具有Cun+离子,n=___,基态时该阳离子的价电子排布式为______。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是___元素。
(3)合成“中国蓝”、“中国紫”的原料有BaCO3,孔雀石Cu2(OH)2CO3和砂子(SiO2)。SiO2晶体中Si原子的杂化轨道是由______轨道(填轨道的名称和数目)和________轨道杂化而成的。
(4)现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源一种阴离子是正四面体的天然钡矿中,则最可能的钡矿化学式是______。
(5)在5500年前,古代埃及人就己经知道如何合成蓝色颜料—“埃及蓝”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中国蓝”一致。CO32一中键角∠OCO为___。根据所学,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更___(填“高”或“低”)。
(6)自然界中的SiO2,硬度较大,主要原因是___。下图为SiO2晶胞中Si原子沿z轴方向在xy平面的投影图(即俯视投影图),其中O原子略去,Si原子旁标注的数字表示每个Si原子位于z轴的高度,则SiA与SiB的距离是_____。
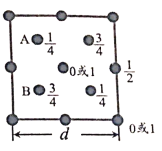
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳捕集与封存是应对气候变化问题的解决方案之一。回答下列问题:
(l)我国科研团队利用低温等离子体协同催化技术,在常温常压下实现了将CO2和CH4一步转化为化工产品。试写出 CO2与CH4合成乙酸的热化学方程式:____。
(甲烷和乙酸的燃烧热分别为-890.31 kJ/mol、-876.72 kJ/mol)
(2)在某一钢性密闭容器中CH4、CO2的分压分别为15 kPa、20 kPa,加入Ni/α-Al2 O3催化剂并加热至1123 K使其发生反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①研究表明CO的生成速率v(CO)=1.28![]() 10-2﹒p(CH4)
10-2﹒p(CH4)![]() p(CO2)(kPa
p(CO2)(kPa![]() s-1),某时刻测得p(H2)=10 kPa,则 p(CH4)=___kPa,v(CO)=___kPa
s-1),某时刻测得p(H2)=10 kPa,则 p(CH4)=___kPa,v(CO)=___kPa![]() s-1。
s-1。
②达到平衡后测得体系压强是起始时的![]() ,则该反应的平衡常数Kp=____kPa)2。
,则该反应的平衡常数Kp=____kPa)2。
(3)氮化镓(GaN)与Cu可组成如图所示的人工光合系统,该装置能以CO2和H2O为原料合成CH4。
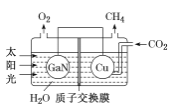
①该装置工作时H+移向____(填“GaN”或“Cu”)电极,该电极上的电极反应式为 ___。
②该装置每产生1 mol CH4,左极室溶液质量减少____g。
③本实验条件下,若CO2转化为烃(如甲烷、乙烯等)的转化率为10%,生成CH4的选择性为12%,现收集到12 mol CH4,则通入的CO2为____mol。(已知:选择性=生成目标产物消耗的原料量/原料总的转化量)
(4)上述人工光合系统装置也可以制备乙烯、乙炔等重要化工原料。2010年Sheth等研究得出乙炔在Pd表面选择加氢的反应机理,如下图所示。其中吸附在Pd表面的物质用“*”标注。
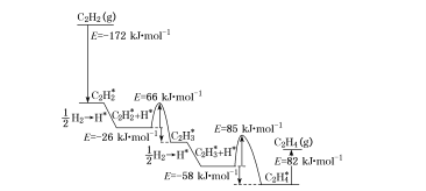
上述吸附反应为 ____填“吸热”或“放热”)反应,该过程中最小能垒(活化能)为___ kJ![]() mol-1,该步骤的化学方程式为____。
mol-1,该步骤的化学方程式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com