
按要求完成下列填空:
(1)已知在标准状况下的四种气体 ①8.96L CH4 ②3.01×1022个HCl分子 ③10.2克H2S ④0.5molNH3用相应的序号填写下列空白:体积最大的是 ④ ;含氢原子数最多的是 .
(2)等物质的量的氧气与臭氧质量之比为 2:3 ,分子个数之比为 1:1 ,电子个数之比为 .
(3)某金属氯化物MCl3 26.7g,含有0.600mol Cl﹣.则金属M的摩尔质量为 27g/mol .
(4)现有10克H218O中,中子数目为 .
| 物质的量的相关计算;摩尔质量;气体摩尔体积;物质分子中的原子个数计算.. | |
| 专题: | 阿伏加德罗常数和阿伏加德罗定律. |
| 分析: | (1)n(CH4)= (2)等物质的量的氧气与臭氧,设物质的量均为1mol,结合分子构成及m=nM计算; (3)MCl3 26.7g,含有0.600mol Cl﹣,n(MCl3)=0.2mol,结合M= (4)10克H218O的物质的量为 |
| 解答: | 解:(1)n(CH4)= 由V=nVm可知,物质的量越大,体积越大,则体积最大的是④,由分子构成可知,含氢原子物质的量分别为1.6mol、0.05mol、0.6mol、1.5mol,最多的为①, 故答案为:④;①; (2)等物质的量的氧气与臭氧,设物质的量均为1mol,则质量之比为1mol×32g/mol:1mol×28g/mol=2:3, 分子个数之比等于物质的量之比,均为1:1, 电子个数之比为1mol×2×8:1mol×3×8=2:3, 故答案为:2:3;1:1;2:3; (3)MCl3 26.7g,含有0.600mol Cl﹣,n(MCl3)=0.2mol,则M= 故答案为:27g/mol; (4)10克H218O的物质的量为 |
| 点评: | 本题考查物质的量的计算,为高频考点,把握物质的量为中心的基本计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大. |


科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法正确的是 ( )
A.1 mol某烷烃分子中含8 mol氢原子,则1 mol该烷烃分子中共价键数为8NA
B.标准状况下,a L氧气和氮气的混合物中含有的分子数为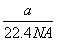
C.1.4 g乙烯分子中含有0.05NA个C=C键
D.1 mol Cl2发生反应时,转移的电子数一定是2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的叙述,正确的是( )
|
| A. | 将固体加入容量瓶中溶解并稀释至刻度,配置成一定物质的量浓度的溶液 |
|
| B. | 某溶液与BaCl2溶液反应生成白色沉淀,说明原溶液中有SO42﹣ |
|
| C. | 用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 |
|
| D. | 可以用湿润的红色石蕊试纸检验是否有氨气生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中不正确的是( )
A.目前,我国城市环境污染中的大气污染物主要是SO2、NO2、CO、烟尘
B.凡含有食品添加剂的食物对人体健康均有害,不可食用
C.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
D.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表1信息,判断以下叙述正确的是( )
表1 部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
 A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
在冶金工业上,通常均不能用化学还原剂制得的金属组是( )
A.Na、Ba、Mg、A1 B.Zn、Fe、Cu、Ag
C.Na、K、Zn、Fe D.Mg、Al、Zn、Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化的主要化学反应方程式为: 。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) 
 CH3OH(g) ΔH=-90.8kJ·mol-1
CH3OH(g) ΔH=-90.8kJ·mol-1
②2CH3OH(g) 
 CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
③CO(g)+H2O(g) 
 CO2(g)+H2(g) ΔH=-41.3kJ·mol-1
CO2(g)+H2(g) ΔH=-41.3kJ·mol-1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式 。
(3)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 。
a.高温高压 b.低温低压 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚 f.加入催化剂
(4)已知反应②2CH3OH(g) 
 CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”、“<”或“=”),若上述情况达到平衡,此时c(CH3OH)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com