
【题目】分子中存在π 键,且碳原子全部以sp杂化轨道成键的是( )
A. CH3CH3B. CH2=CH2C. CH≡CHD. ![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.60g二氧化硅晶体中含有2NA个硅氧键
B.18g氨基(—ND2)中含有的电子数为9NA
C.80 °C时,lLpH =1的硫酸溶液中,含有的OH—数目为10—13NA
D.氯碱工业中,导线上流过NA个电子,则阳极放出氯气11.2 L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于驱动检验管道焊缝设备爬行器的甲醇-燃料电池的工作原理示意如图,下列有关该电池说法正确的是
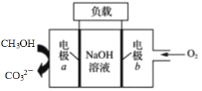
A.该电池工作时,每消耗22.4 L CH3OH转移6 mol电子
B.电子由电极a经负载流向电极b,再经过氢氧化钠溶液返回电极a,形成闭合回路
C.电池工作时,OH-向电极a移动,溶液的pH减小
D.电极b上发生的电极反应为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Ca2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1 mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如右实验:则下列关于原溶液的判断正确的是( )

A.若步骤中Ba(NO3)2和HNO3的混合溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B.无法确定原溶液中是否存在Cl-
C.肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D.肯定不存在的离子是Ca2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积增大
A. ①②B. ①③C. ②③D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组开展模拟工业合成氨的制备实验,在2 L密闭容器内,t℃时发生反应:N2 (g)+3 H2 (g) ![]() 2 NH3 (g),在体系中,n(N2)随时间的变化如下表:
2 NH3 (g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1) 上述反应在第5min时,N2的转化率为___________________ ;
(2) 用H2表示从0~2 min内该反应的平均速率v(H2)=______________________;
(3) t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为________________________(用字母填空,下同);
a.v(NH3)=0.05 mol L-1-min-1 b.v(H2)=0.03 mol L-1-min-1
c.v(N2)=0.02mol L-1-min-1 d.v(H2)=0.001 mol L-1- s -1
(4) 下列表述能作为上述实验中可逆反应N2 (g)+3 H2 (g) ![]() 2 NH3 (g) 达到化学平衡状态的标志是_________________________ ;
2 NH3 (g) 达到化学平衡状态的标志是_________________________ ;
a. 反应速率v(N2):v(H2):v(NH3)=1:3:2
b. 各组分的物质的量浓度不再改变
c. 混合气体的平均相对分子质量不再改变
d. 混合气体的密度不变
e. 单位时间内生成n mol N2的同时,生成3n mol H2。
f. v(N2)消耗=2 v(NH3)消耗
g. 单位时间内3mol H﹣H键断裂的同时2mol N﹣H键也断裂
(5) 下列措施不能使上述化学反应速率加快的是_____________。
a.及时分离出NH3气体 b.适当升高温度
c.增大N2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据原电池原理,回答下列问题:

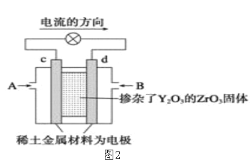
(1)图1是依据氧化还原反应:Cu(s)+2Fe3+(aq)=Cu2+(aq)+2Fe2+(aq)设计的原电池装置。
①电极X的材料是________(填化学名称);电极Y的材料是__________(填化学名称)。
②Y电极发生的电极反应式为:______________。
(2)图2是使用固体电解质的燃料电池,装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-离子(O2+4e―→2O2-)。
①c电极为______________极。(填“正”或“负”)
②d电极上的电极反应式为___________________________。
③如果消耗甲烷160g,假设化学能完全转化为电能,则转移电子的数目为______________(用NA表示),需要消耗标准状况下氧气的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空题。请完成以下有关计算:
(1)标准状况下,m g A气体与n g B气体分子数相等,25℃时,1 kg气体A与1 kg气体B的分子数之比为________ 。
(2)m g某M溶于盐酸中,放出的气体在标准状况下的体积为n L,并生成氯化物MCl2,则金属M的相对原子质量是________。
(3)如图有三只气球,其中VA=VB=1.12 L。
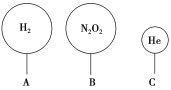
①A、B中气体的物质的量____(填“一定”或“不一定”)是0.05 mol。
②标准状况下,A、B气球中的分子个数比为_________。
③相同温度和压强下,A、C气球中气体的质量相等,则V(A)∶V(C)=__________
(4)取100 mL 0.3 mol·L-1和300 mL 0.25 mol·L-1的硫酸注入500 mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com