
【题目】香豆素类药物的作用是抑制凝血因子在肝脏的合成。图是香豆素的一种合成路线:

已知:
(1)A→B的反应类型为______________。
(2)C的化学名称为_______________。
(3)完成下列化学方程式:
①D在一定条件下发生加聚反应:_______________;
② E→香豆素:_________________。
(4)C有多种同分异构体,其中含苯环的共有___________种(不考虑立体异构),这些同分异构体在下列仪器中显示的信(或收据)完全相同,该仪器是____________(填序号)。
A.质谱仪 B.红外光谱仪C.元素分析仪 D.核磁共振仪
(5)已知:同一个碳上连有两个羟基通常不稳定,易脱水形成羰基。以甲苯为取料(其他无机试剂任选) 制备化合物C (目标化合物),请在横线上将合成路线的后半部分补充完整。

____________________________________________
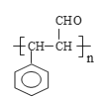
【答案】 氧化反应 邻羟基苯甲醛或2羟基苯甲醛 n![]() →
→
![]() →
→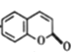 +H2O 4 C
+H2O 4 C ![]()
【解析】本题考查有机物推断和合成,根据香豆素的结构简式,E生成香豆素,发生酯化反应,则E的结构简式为![]() ,根据D生成E反应的条件,D→E发生醛基的氧化,D的结构简式为:
,根据D生成E反应的条件,D→E发生醛基的氧化,D的结构简式为:![]() ,根据信息以及C的结构简式,B的结构简式为CH3CHO,A为CH3CH2OH,C的结构简式为:
,根据信息以及C的结构简式,B的结构简式为CH3CHO,A为CH3CH2OH,C的结构简式为:![]() ,(1)A→B发生醇的氧化,即反应类型为氧化反应;(2)根据C的结构简式,C名称为邻羟基苯甲醛或2羟基苯甲醛;(3)①根据D的结构简式,D中含有碳碳双键,发生加聚反应方程式为:n
,(1)A→B发生醇的氧化,即反应类型为氧化反应;(2)根据C的结构简式,C名称为邻羟基苯甲醛或2羟基苯甲醛;(3)①根据D的结构简式,D中含有碳碳双键,发生加聚反应方程式为:n![]()
![]()
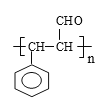 ;②发生酯化反应,其反应方程式为:
;②发生酯化反应,其反应方程式为:![]()
![]()
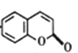 +H2O;(4)根据C的结构简式,醛基和羟基处于间位和对位,然后把醛基和羟基看作是羧基,即结构简式为
+H2O;(4)根据C的结构简式,醛基和羟基处于间位和对位,然后把醛基和羟基看作是羧基,即结构简式为![]() ,羧酸和酯互为同分异构体,即
,羧酸和酯互为同分异构体,即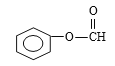 ,因此有4种结构,A、质谱仪是测的相对分子质量,质荷比最大的是相对分子质量,虽然相对分子质量相同,但其他质荷比不同,故A错误;B、红外光谱是不同化学键或官能团吸收频率不同,因此红外光谱图不同,故B错误;C、元素分析仪分析元素组成,故C正确;D、核磁共振仪测的是不同化学环境下的氢原子,根据同分异构体,故D错误;(5)根据C的结构简式,甲基转变成醛基,根据信息,甲基上引入两个氯原子,然后水解,因为酚羟基显酸性,与氢氧化钠反应生成-ONa,然后加酸得到目标产物,因此路线是
,因此有4种结构,A、质谱仪是测的相对分子质量,质荷比最大的是相对分子质量,虽然相对分子质量相同,但其他质荷比不同,故A错误;B、红外光谱是不同化学键或官能团吸收频率不同,因此红外光谱图不同,故B错误;C、元素分析仪分析元素组成,故C正确;D、核磁共振仪测的是不同化学环境下的氢原子,根据同分异构体,故D错误;(5)根据C的结构简式,甲基转变成醛基,根据信息,甲基上引入两个氯原子,然后水解,因为酚羟基显酸性,与氢氧化钠反应生成-ONa,然后加酸得到目标产物,因此路线是![]() 。
。


科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为________。
(2)B为0.1 mol·L1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:____________________________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入________,目的是_________________;若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,2.0×103 mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F)与溶液pH的变化关系如图所示。

(1)25℃时,HF的电离平衡常数Ka=_____________。
(2)已知HF(aq)![]() H+(aq)+F(aq) ΔH=10.4 kJ/mol,现将室温下0.1 mol/L HF溶液升温至30℃(不考虑溶质和溶剂的挥发),下列各量增大的是__________。
H+(aq)+F(aq) ΔH=10.4 kJ/mol,现将室温下0.1 mol/L HF溶液升温至30℃(不考虑溶质和溶剂的挥发),下列各量增大的是__________。
a.Ka b.Kw c.n(H+) d.![]()
(3)25℃时,在20 mL 0.1 mol/L氢氟酸中加入V mL 0.1 mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是__________________。

a.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
b.①点时pH=6,此时溶液中,c(F)c(Na+)=9.9×107 mol/L
c.②点时,溶液中的c(F)=c(Na+)
d.③点时V=20 mL,此时溶液中c(F)<c(Na+)=0.1 mol/L
(4)25℃时,SrF2(s)的Ksp=2×109,若将0.20 mol/L NaF(aq)与0.20 mol/L Sr(NO3)2(aq)等体积混合后,溶液中F浓度约为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍硬而有延展性并具有铁磁性,能够高度磨光和抗腐蚀。下图是一种以含镍废料(主要是NiO,含少量FeO、SiO2等杂质)制备Ni的流程:

已知:室温下难溶物的溶度积数据如下表:
化合物 | Ni(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-15 | 10-15 | 10-38 |
(1)滤渣1的主要成分为_____________(填化学式)。
(2)实验中需用0.8mol/L的稀硫酸800mL,若用98%的浓硫酸(ρ=1.84g·mL-l)来配制,量取浓硫酸
时,需使用的量筒的规格为_________(填序号)。
A.10mL B.20mL C.50mL D.l00tnL
(3)用离子方程式解释加入H2O2的作用:_________________。
(4)滴加氨水调节至pH为_________时,铁刚好沉淀完全;若继续滴加氨水至pH为_____________时,镍开始沉淀(假定Ni2+浓度为0.lmol/L)。若上述过程中没有“氧化”步骤,其后果是_______________。
(5)电解制备镍的反应原理如图所示,则A电极的反应式为2H++2e-=H2↑和___________________。

(6)若用a kg含镍废料(含NiO 80%)制备Ni,最终得到产品b kg,则产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g)![]() 2N2+3H2O(g) ΔH<0
2N2+3H2O(g) ΔH<0
在恒容的密闭容器中,下列有关说法正确的是
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证Cl2、Br2的氧化性强弱,设计了如下实验: 
(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)
实验步骤如上图,填写图中的空白.
(1)2mL试剂为;加入少量试剂;再加入试剂;
(2)现象: .
(3)可以证明Cl2的氧化性(填“强于”或“弱于”)Br2的氧化性,此反应的离子方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的矿产、能源和水产资源,如图所示为利用海水的部分流程。

下列有关说法正确的是( )
A. 过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B. 工业上通过电解饱和MgCl2溶液制取金属镁
C. 过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2
D. 在③④⑤步骤中,溴元素均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s) + 2NO(g) ![]() N2(g) + CO2(g) ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g) + CO2(g) ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率
v(N2)= mol·L-1·min-1;计算该反应的平衡常数K= 。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 (填字母代号)。
A.加入合适的催化剂
B.适当缩小容器的体积
C.通入一定量的NO
D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),ΔH 0(填“>”或“<”).
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式 。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素R原子的核外电子数等于核内中子数,该元素的单质2.8g与氧气充分反应,生成6.0g的化合物RO2 . 请回答:
(1)元素R的原子序数是 .
(2)元素R的原子共有个电子层,能量最低的电子层中共有个电子.
(3)写出元素R的最高价氧化物对应水化物的化学式 , 它的酸性比碳酸的酸性 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com