
【题目】以![]() 、NaOH、
、NaOH、![]() 尿素
尿素![]() 和
和![]() 为原料可制备
为原料可制备![]() 水合肼
水合肼![]() 和无水
和无水![]() ,其主要实验流程如下:
,其主要实验流程如下:
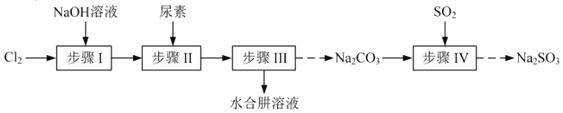
已知:①![]() 是放热反应。
是放热反应。
②![]() 沸点约
沸点约![]() ,具有强还原性,能与 NaClO剧烈反应生成
,具有强还原性,能与 NaClO剧烈反应生成![]() 。
。
(1)步骤I制备NaClO溶液时,若温度超过![]() ,
,![]() 与NaOH溶液反应生成
与NaOH溶液反应生成 ![]() 和NaCl,其离子方程式为______;实验中控制温度计温度除用冰水浴外,还需采取的措施是______。
和NaCl,其离子方程式为______;实验中控制温度计温度除用冰水浴外,还需采取的措施是______。
(2)步骤Ⅱ合成![]() 的装置如图
的装置如图![]() 所示。 NaClO碱性溶液与尿素水溶液在
所示。 NaClO碱性溶液与尿素水溶液在![]() 以下反应一段时间后,再迅速升温至
以下反应一段时间后,再迅速升温至![]() 继续反应。实验中通过滴液漏斗滴加的溶液是______;使用冷凝管的目的是______。
继续反应。实验中通过滴液漏斗滴加的溶液是______;使用冷凝管的目的是______。
(3)步骤Ⅳ用步骤Ⅲ得到的副产品![]() 制备无水
制备无水![]() 水溶液中
水溶液中![]() 、
、![]() 、
、![]() 随pH的分布如图
随pH的分布如图![]() 所示,
所示,![]() 的溶解度曲线如图
的溶解度曲线如图![]() 所示
所示![]() 。
。
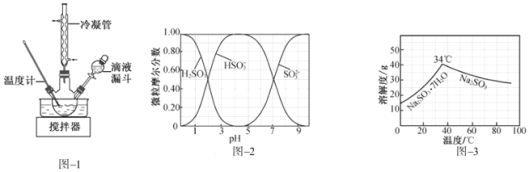
①边搅拌边向![]() 溶液中通入
溶液中通入![]() 制备
制备 ![]() 溶液。实验中确定何时停止通
溶液。实验中确定何时停止通![]() 的实验操作为______。
的实验操作为______。
②请补充完整由 ![]() 溶液制备无水
溶液制备无水![]() 的实验方案:______,用少量无水乙醇洗涤,干燥,密封包装。
的实验方案:______,用少量无水乙醇洗涤,干燥,密封包装。
【答案】![]() 缓慢通入氯气 NaClO碱性溶液 减少水合肼的挥发 测量溶液的pH,若pH约为4,停止通
缓慢通入氯气 NaClO碱性溶液 减少水合肼的挥发 测量溶液的pH,若pH约为4,停止通![]() 边搅拌边向
边搅拌边向![]() 溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于
溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于![]() 条件下趁热过滤
条件下趁热过滤
【解析】
由实验流程可知步骤Ⅰ为氯气和氢氧化钠溶液的反应,生成NaClO,为避免生成NaClO3,应控制温度在40℃以下,生成的NaClO与尿素反应生成N2H4H2O和Na2CO3,可用蒸馏的方法分离出N2H4H2O,副产品Na2CO3溶液中通入二氧化硫,可制得Na2SO3,结合对应物质的性质以及题给信息解答该题。
(1)温度超过40℃,Cl2与NaOH溶液反应生成 NaClO3和NaC1,反应的离子方程式为![]() ,实验中控制温度计温度除用冰水浴外,还应控制通入氯气的速率,避免反应过于剧烈,放出大量的热而导致温度升高;故答案为:
,实验中控制温度计温度除用冰水浴外,还应控制通入氯气的速率,避免反应过于剧烈,放出大量的热而导致温度升高;故答案为:![]() ;缓慢通入氯气;
;缓慢通入氯气;
(2)实验中通过滴液漏斗滴加的溶液是NaClO碱性溶液,避免N2H4H2O与NaClO剧烈反应生成N2,为避免N2H4H2O的挥发,可使用冷凝管回流;故答案为:NaClO碱性溶液;减少水合肼的挥发;
(3)用Na2CO3制备无水Na2SO3,在Na2CO3溶液中通入过量的二氧化硫生成NaHSO3,然后在NaHSO3溶液中加入NaOH溶液可生成Na2SO3,
①由图象可知,如溶液pH约为4时,可完全反应生成NaHSO3,此时可停止通入二氧化硫,可通过测量溶液pH的方法控制;故答案为:测量溶液的pH,若pH约为4,停止通SO2;
②由NaHSO3溶液制备无水Na2SO3,可边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,由图象可知pH约为10时,可完全反应生成Na2SO3,此时停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,由图象3可知在高于34℃条件下趁热过滤,可得到无水Na2SO3;故答案为:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤。


科目:高中化学 来源: 题型:
【题目】β硝基苯乙烯是一种黄色针状晶体,熔点55~58 ℃,沸点250~260 ℃,不溶于水,易溶于乙酸、二氯甲烷等有机溶剂。制备原理如下:
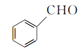 +CH3NO2
+CH3NO2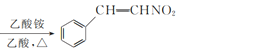
(1) 反应装置冷凝管中水应从________(填“a”或“b”)处通入。
(2)制备过程中,需在搅拌下滴加苯甲醛,控制滴加速率反应6 h,加热温度在110 ℃左右,那么采用的加热方法为________,如温度过高时,则可以采取________措施。
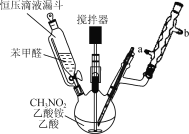
(3)反应混合液需加入一定量的水才析出黄色絮状物,加水的作用是________。
(4)过滤后用95%乙醇重结晶,再进行抽滤可获得黄色棱形晶体。抽滤装置所包含的仪器除减压系统外还有布氏漏斗和________(填仪器名称)。
(5)实验中使用恒压滴液漏斗的优点是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4中含有![]() 、
、![]() ,分别表示为Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程示意图如图所示,下列说法不正确的是
,分别表示为Fe(Ⅱ)、Fe(Ⅲ),以Fe3O4/Pd为催化材料,可实现用H2消除酸性废水中的致癌物NO2-,其反应过程示意图如图所示,下列说法不正确的是

A. Pd上发生的电极反应为:H2 - 2e- 2H+
B. Fe(Ⅱ)与Fe(Ⅲ)的相互转化起到了传递电子的作用
C. 反应过程中NO2-被Fe(Ⅱ)还原为N2
D. 用该法处理后水体的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,有关制备途径及性质如下图所示。下列说法错误的是( )

A.途径①所用混酸中H2SO4与HNO3的最佳物质的量之比为3:2
B.与途径①、③相比,途径②更好地体现了绿色化学思想
C.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量①=②<③
D.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)今年来我国多个省市出现严重的雾霾天气。导致雾霾形成的主要污染物是___________(填字母)。
a.SO2 b.NO2 c.CO2 d.PM2.5
(2)天然水中杂质较多,常需加入明矾,ClO2等物质处理后才能饮用。明矾能净水的原理是_______,写出检验明矾中Al3+的实验方法________。
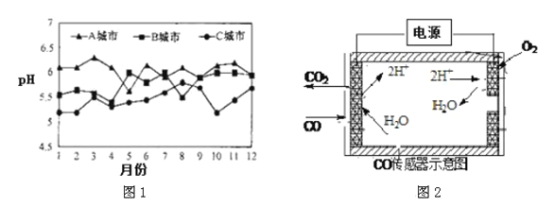
(3)A、B、C 三个城市全年雨水的月平均pH变化如下图1 所示。
①受酸雨危害最严重的是_____________城市。
②汽车尾气中含有NO2、NO、CO 等有害气体,写出由NO2形成硝酸型酸雨的化学方程式______________。
③用纳米二氧化钛光触媒技术,将汽车尾气中的NOx 和CO 转化为无害气体,写出该反应的化学方程式____________________。
④测量汽车尾气的浓度常用电化学气敏传感器,其中CO 传感器可用下图2 简单表示,则阳极发生的电极反应_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,在水中存在沉淀溶解平衡:CdS(s)![]() Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )
Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )

A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图

请回答下列问题(用元素符号表达):
(1) X、Y、Z 三种元素的原子半径大小顺序是____________
(2)X 与 Y 形成化合物Y2X2,写出该化合物的电子式____________
(3)RX2是一种强氧化性气体,可用于污水处理,能将 CN-氧化,生成两种无毒气体,该反应离子方程式为 ____________
(4)某阴离子 Wa2-(a 为2 6之间的数字)在碱性溶液中被 BrO3离子氧化为 WO42-,而BrO3-离子被还原为Br-,反应中消耗的 BrO3-离子和 OH离子的物质的量之比为 2:3,则 a =____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

图1 图2 图3 图4
A. 图1表示0.1molMgCl2·6H2O在空气中充分加热时固体质量随时间的变化
B. 图2表示用0.1000 mol·LˉlNaOH溶液滴定25.00 mLCH3COOH的滴定曲线,则c(CH3COOH)=0.0800 mol·Lˉ1
C. 图3表示恒温恒容条件下,2NO2(g)![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
D. 图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“除氢气外,烃、肼、甲醇、氨、煤气等液体或气体,均可作燃料电池的燃料”。已知肼燃烧时发生下列反应,N2H4+O2![]() N2+2H2O。以Pt为电极,以硫酸为电解质溶液组成肼燃料电池,下列关于肼燃料电池的说法中不正确是 )
N2+2H2O。以Pt为电极,以硫酸为电解质溶液组成肼燃料电池,下列关于肼燃料电池的说法中不正确是 )
A. 肼是燃料电池的负极反应物,O2是正极反应物
B. 肼燃料电池的正极反应为 O2 + 2H2O + 4e-= 4OH-
C. 肼燃料电池的负极反应为:N2H4 —4e—=N2↑+4H+
D. 电池工作过程中H+向正极移动,但H+物质的量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com