
【题目】如图是部分短周期元素化合价与原子序数的关系图

请回答下列问题(用元素符号表达):
(1) X、Y、Z 三种元素的原子半径大小顺序是____________
(2)X 与 Y 形成化合物Y2X2,写出该化合物的电子式____________
(3)RX2是一种强氧化性气体,可用于污水处理,能将 CN-氧化,生成两种无毒气体,该反应离子方程式为 ____________
(4)某阴离子 Wa2-(a 为2 6之间的数字)在碱性溶液中被 BrO3离子氧化为 WO42-,而BrO3-离子被还原为Br-,反应中消耗的 BrO3-离子和 OH离子的物质的量之比为 2:3,则 a =____________。
【答案】Na>Al>O  2ClO2+2CN-=N2+2CO2+2Cl- 3S52-+16BrO3-+24OH-=15SO42-+16Br-+12H2O
2ClO2+2CN-=N2+2CO2+2Cl- 3S52-+16BrO3-+24OH-=15SO42-+16Br-+12H2O
【解析】
都是短周期元素,由表中化合价可知,X的化合价为-2价,没有正化合价,故X为O元素,Y的化合价为+1价,处于ⅠA族,原子序数大于O元素,故Y为Na元素,Z为+3价,原子序数大于Na为Al元素,W的化合价为+6、-2价,故W为S元素,R的最高正价为+7价,应为Cl元素,结合元素周期律与元素化合物的性质解答该题;
(4) W为S元素,则S元素的化合价由-![]() 升高为+6价,Br元素的化合价由+5价降低为-1价,BrO3-和OH-的物质的量之比为2:3,2xSa2-+4BrO3-+6OH-→2xaSO42-+4Br-+3H2O,由电荷守恒可知,4x+4+6=4xa+4,由氧原子守恒可知18=8xa+3,解得x=
升高为+6价,Br元素的化合价由+5价降低为-1价,BrO3-和OH-的物质的量之比为2:3,2xSa2-+4BrO3-+6OH-→2xaSO42-+4Br-+3H2O,由电荷守恒可知,4x+4+6=4xa+4,由氧原子守恒可知18=8xa+3,解得x=![]() ,a=5,以此解答。
,a=5,以此解答。
由分析知:X为O元素、Y为Na元素、Z为Al元素、W为S元素、R为Cl元素;
(1)同周期随原子序数增大,原子半径减小,同主族自上而下原子半径增大,故原子半径Na>Al>O;
(2)O 与 Na 形成化合物Na2O2,是离子型化合物,其电子式为 ;
;
(3)ClO2是一种强氧化性气体,能将 CN-氧化,生成N2和CO2,则该反应离子方程式为2ClO2+2CN-=N2+2CO2+2Cl-;
(4) BrO3-和OH-的物质的量之比为2:3,2xSa2-+4BrO3-+6OH-→2xaSO42-+4Br-+3H2O,由电荷守恒可知,4x+4+6=4xa+4,由氧原子守恒可知18=8xa+3,解得x=![]() ,a=5;2xSa2-+4BrO3-+6OH-→2xaSO42-+4Br-+3H2O,a=5时,离子反应为3S52-+16BrO3-+24OH-=15SO42-+16Br-+12H2O。
,a=5;2xSa2-+4BrO3-+6OH-→2xaSO42-+4Br-+3H2O,a=5时,离子反应为3S52-+16BrO3-+24OH-=15SO42-+16Br-+12H2O。


科目:高中化学 来源: 题型:
【题目】2019年为国际化学元素周期表年。鉝(Lv)是116号主族元素。下列说法不正确的是( )
A.Lv位于第七周期第ⅥA族B.Lv在同主族元素中金属性最弱
C.Lv的同位素原子具有相同的电子数D.中子数为177的Lv核素符号为![]() Lv
Lv
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加的铁粉的物质的量(横坐标)的关系如图所示,AB段与BC段所需Fe的质量比为( )
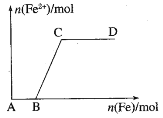
A.2:1B.1:2C.1:4D.3:8
查看答案和解析>>
科目:高中化学 来源: 题型:
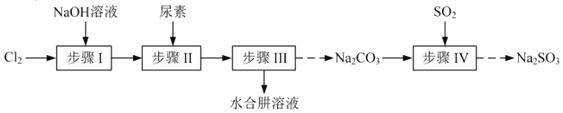
【题目】以![]() 、NaOH、
、NaOH、![]() 尿素
尿素![]() 和
和![]() 为原料可制备
为原料可制备![]() 水合肼
水合肼![]() 和无水
和无水![]() ,其主要实验流程如下:
,其主要实验流程如下:
已知:①![]() 是放热反应。
是放热反应。
②![]() 沸点约
沸点约![]() ,具有强还原性,能与 NaClO剧烈反应生成
,具有强还原性,能与 NaClO剧烈反应生成![]() 。
。
(1)步骤I制备NaClO溶液时,若温度超过![]() ,
,![]() 与NaOH溶液反应生成
与NaOH溶液反应生成 ![]() 和NaCl,其离子方程式为______;实验中控制温度计温度除用冰水浴外,还需采取的措施是______。
和NaCl,其离子方程式为______;实验中控制温度计温度除用冰水浴外,还需采取的措施是______。
(2)步骤Ⅱ合成![]() 的装置如图
的装置如图![]() 所示。 NaClO碱性溶液与尿素水溶液在
所示。 NaClO碱性溶液与尿素水溶液在![]() 以下反应一段时间后,再迅速升温至
以下反应一段时间后,再迅速升温至![]() 继续反应。实验中通过滴液漏斗滴加的溶液是______;使用冷凝管的目的是______。
继续反应。实验中通过滴液漏斗滴加的溶液是______;使用冷凝管的目的是______。
(3)步骤Ⅳ用步骤Ⅲ得到的副产品![]() 制备无水
制备无水![]() 水溶液中
水溶液中![]() 、
、![]() 、
、![]() 随pH的分布如图
随pH的分布如图![]() 所示,
所示,![]() 的溶解度曲线如图
的溶解度曲线如图![]() 所示
所示![]() 。
。
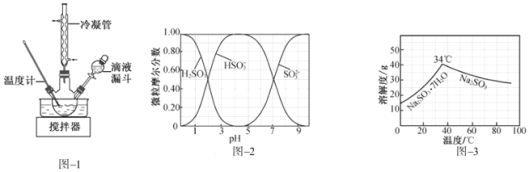
①边搅拌边向![]() 溶液中通入
溶液中通入![]() 制备
制备 ![]() 溶液。实验中确定何时停止通
溶液。实验中确定何时停止通![]() 的实验操作为______。
的实验操作为______。
②请补充完整由 ![]() 溶液制备无水
溶液制备无水![]() 的实验方案:______,用少量无水乙醇洗涤,干燥,密封包装。
的实验方案:______,用少量无水乙醇洗涤,干燥,密封包装。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于![]() 水解的说法错误的是( )
水解的说法错误的是( )
A.在稀溶液中,水解达到平衡时,无论加![]() 饱和溶液还是加水稀释,平衡均向右移动
饱和溶液还是加水稀释,平衡均向右移动
B.浓度为![]() 和
和![]() 的两种
的两种![]() 溶液,其他条件相同时,
溶液,其他条件相同时,![]() 的水解程度前者小于后者
的水解程度前者小于后者
C.其他条件相同时,同浓度的![]() 溶液在50 ℃和20 ℃时发生水解,50 ℃时
溶液在50 ℃和20 ℃时发生水解,50 ℃时![]() 的水解程度比20 ℃时的小
的水解程度比20 ℃时的小
D.为抑制![]() 的水解,更好地保存
的水解,更好地保存![]() 溶液,应加少量盐酸
溶液,应加少量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是( )
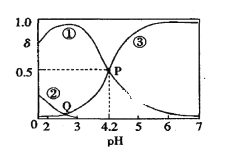
A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. 20℃时,H2C2O4的二级电离平衡常数Ka2=1×10-4.2
C. Q点对应溶液中lgc(H+)<lgc(OH-)
D. 0.100mol·L-1的NaHC2O4溶液中:c(OH-)=c(H+)-2c(C2O42-)+c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示0.001 mol·L-1盐酸滴定0.001 mol·L-1 NaOH溶液的滴定曲线
B. 图2表示从能量角度考虑,石墨比金刚石稳定
C. 图3表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中含大量Al3+
D. 图4所示图中的阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,向
时,向![]() 溶液滴加入
溶液滴加入![]() 的盐酸,滴定曲线如图1所示,CN-、HCN浓度所占分数
的盐酸,滴定曲线如图1所示,CN-、HCN浓度所占分数![]() 随pH变化的关系如图2所示,下列表述正确的是
随pH变化的关系如图2所示,下列表述正确的是![]()

A.b点时,溶液中微粒浓度大小的关系:![]()
B.d点溶液垂直的关系:![]()
C.图2中的e点对应图1中的c点
D.在滴定过程中选用酚酞试剂比选用甲基橙试剂作指示剂误差更小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒奶粉中发现的化工原料三聚氰胺可以由下列反应合成:CaO+3C![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2![]() CaCN2+C,CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CaCN2+C,CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)基态钙原子电子占据的最高能层符号是_________,其核外共有______种不同能量的电子。
(2)CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O,由此可以推知CN22-的空间构型为________。
(3)1mol尿素分子[CO(NH2)2]中含有的π键与σ键的数目之比为_________;所含元素的电负性由大到小的顺序为_____________。
(4)三聚氰胺俗称“蛋白精”,其结构为:
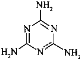
其中氮原子的杂化方式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com