
����Ŀ�����̷��з��ֵĻ���ԭ�������谷���������з�Ӧ�ϳɣ�CaO��3C![]() CaC2��CO����CaC2��N2
CaC2��CO����CaC2��N2![]() CaCN2��C��CaCN2��2H2O=NH2CN��Ca(OH)2��NH2CN��ˮ��Ӧ��������[CO(NH2)2]�����غϳ������谷��
CaCN2��C��CaCN2��2H2O=NH2CN��Ca(OH)2��NH2CN��ˮ��Ӧ��������[CO(NH2)2]�����غϳ������谷��
(1)��̬��ԭ�ӵ���ռ�ݵ�����ܲ������_________��������______�ֲ�ͬ�����ĵ��ӡ�
(2)CaCN2��������ΪCN22-����CN22-��Ϊ�ȵ�����ķ�����N2O���ɴ˿�����֪CN22-�Ŀռ乹��Ϊ________��
(3)1mol���ط���[CO(NH2)2]�к��е���������������Ŀ֮��Ϊ_________������Ԫ�صĵ縺���ɴ�С��˳��Ϊ_____________��
(4)�����谷�׳�������������ṹΪ��
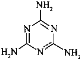
���е�ԭ�ӵ��ӻ���ʽΪ________��
���𰸡�N 6 ֱ���� 1:7 O>N>C>H sp2 sp3
��������
(1)�Ƶ�ԭ������Ϊ20����̬��ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p64s2��
(1)�Ƶ�ԭ������Ϊ20����̬��ԭ�ӵĵ����Ų�ʽΪ1s22s22p63s23p64s2������ռ�ݵ�����ܲ������N���Ӳ㣬�ܲ���ͬ��ͬһ�ܼ��ϵĵ��ӣ����ӵ���չ����ͬ����������ͬ����ͬ�����ĵ�����Ŀ���ܼ���Ŀ��ȣ�������6�ֲ�ͬ�����ĵ��ӣ��ʴ�Ϊ��N��6��
��2��CN22-���ӵ�ԭ�Ӹ���Ϊ3���۵�����Ϊ16����CN22-������ͬԭ�Ӹ����ͼ۵������ĵȵ�����ķ�����N2O��CO2���ȵ����������ͬ�Ŀռ乹�ͣ�CO2�Ŀռ乹��Ϊֱ���Σ���CN22-�Ŀռ乹��Ϊֱ���Σ��ʴ�Ϊ��ֱ���Σ�
��3�����ط�������6��������1��˫����һ����������һ���Ҽ���˫������һ���Ҽ������������������������Ŀ֮��Ϊ1��7��Ԫ�طǽ�����Խǿ���縺��Խ������������Ԫ�صĵ縺���ɴ�С��˳��ΪO>N>C>H���ʴ�Ϊ��1:7��O>N>C>H��
��4�������谷�л��ϵĵ�ԭ����̼ԭ�Ӽ��γ�˫������ԭ�Ӳ���sp2�ӻ��������ϵ�ԭ����̼ԭ�Ӻ���ԭ���Ե�����������ԭ�Ӳ���sp3�ӻ����ʴ�Ϊ��sp2��sp3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ�ػ��ϼ���ԭ�������Ĺ�ϵͼ

��ش���������(��Ԫ�ط��ű���)��
(1) X��Y��Z ����Ԫ�ص�ԭ�Ӱ뾶��С˳����____________
(2)X �� Y �γɻ�����Y2X2��д���û�����ĵ���ʽ____________
(3)RX2��һ��ǿ���������壬��������ˮ�������ܽ� CN-�������������������壬�÷�Ӧ���ӷ���ʽΪ ____________
(4)ij������ Wa2-(a Ϊ2 6֮�������)�ڼ�����Һ�б� BrO3��������Ϊ WO42-����BrO3-���ӱ���ԭΪBr-����Ӧ�����ĵ� BrO3-���Ӻ� OH���ӵ����ʵ���֮��Ϊ 2��3���� a =____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������仯�����ڹ�ҵ���й㷺��Ӧ�á���ij����[�ɷ�ΪNiFe2O4(������)��NiO��FeO��CaO��SiO2��]�л���NiSO4�Ĺ����������£�

��֪(NH4)2SO4��350��ֽ�����NH3��H2SO4���ش��������⣺
(1)���������ijɷ���Fe2O3��FeO(OH)��CaSO4�⣬������___________(д��ѧʽ)��
(2)�����в���FeO����ʱ��H2SO4��Ӧ����Fe2(SO4)3�Ļ�ѧ����ʽΪ_______________��
(3)��ȡҺ���м���NaF�Գ�ȥ��Һ��Ca2+(Ũ��Ϊ1��0��10-3mol��L-1)������Һ��c(F-)=2��0��10-3mol��L-1ʱ��������Ϊ______________[Ksp(CaF2)=4��0��10-11]��
(4)�ܼ���ȡ�����ڶ���Һ�еĽ������ӽ��и�������룺![]() ����ȡ������Һ�������(V0��VA)����Һ��Ni2+��Fe2+����ȡ��Ӱ����ͼ��ʾ��V0��VA�����ȡֵΪ______����___________(�ǿ���ԡ���ǿ���ԡ������ԡ�)�����С�����ȡ����ʹ�л���������ѭ�����á�
����ȡ������Һ�������(V0��VA)����Һ��Ni2+��Fe2+����ȡ��Ӱ����ͼ��ʾ��V0��VA�����ȡֵΪ______����___________(�ǿ���ԡ���ǿ���ԡ������ԡ�)�����С�����ȡ����ʹ�л���������ѭ�����á�

(5)��Fe��NiΪ�缫��ȡNa2FeO4��ԭ����ͼ��ʾ��ͨ��������缫���������Ϻ�ɫ��FeO42-����pH���ߣ����缫����������ɫ���ʡ�

�ٵ��ʱ�����ĵ缫��ӦʽΪ________________�����ӽ���Ĥ(b))Ϊ______(�����������)���ӽ���Ĥ��
�������缫�����ֵĺ��ɫ�����м���������NaClO��Һ�������ܽ⡣�÷�Ӧ�����ӷ���ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������⣬�����¡��״�������ú����Һ������壬������ȼ�ϵ�ص�ȼ��������֪��ȼ��ʱ�������з�Ӧ��N2H4+O2![]() N2+2H2O����PtΪ�缫��������Ϊ�������Һ�����ȼ�ϵ�أ����й�����ȼ�ϵ�ص�˵���в���ȷ�� )
N2+2H2O����PtΪ�缫��������Ϊ�������Һ�����ȼ�ϵ�أ����й�����ȼ�ϵ�ص�˵���в���ȷ�� )
A. ����ȼ�ϵ�صĸ�����Ӧ�O2��������Ӧ��
B. ��ȼ�ϵ�ص�������ӦΪ O2 + 2H2O + 4e��= 4OH��
C. ��ȼ�ϵ�صĸ�����ӦΪ��N2H4 ��4e��=N2��+4H+
D. ��ع���������H+�������ƶ�����H+���ʵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����( )
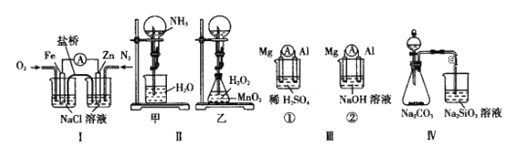
A.ͼIװ����ͨ��N2��O2����������ͬ��
B.ͼII�мס�����װ�ò�����Ȫ��ԭ��һ��
C.ͼIII��װ����þƬ��ԭ��صĸ�������װ��þƬ��ԭ��ص�����
D.ͼIV��Һ©����ʢ������֤���ǽ�������N��C��Si��ʢ������֤���ǽ�������S��C��Si
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽����ҵ���ϵ������ã�ij��ѧ��ȤС���������ͼ1ʵ�����̣��ú�����������ͭ�ĺϽ������ȡ�Ȼ������̷����壨FeSO47H2O���͵���������ش�
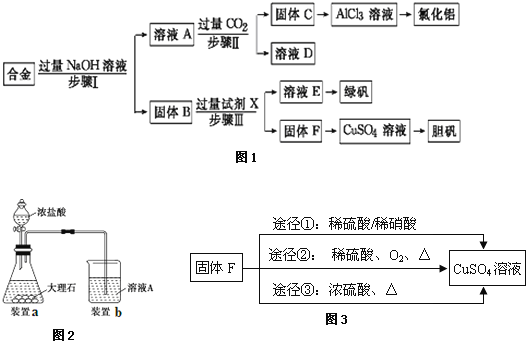
��1��д�������Ӧ�����ӷ���ʽ�� ______ ��
��2���Լ�X�� ______��������о�����е�ʵ������� ______��
��3�����в����ʱ����С������ͼ2��ʾװ�ü��Լ���ȡCO2�����Ƶõ�����ͨ����ҺA�У�һ��ʱ��۲쵽�ձ��в����İ�ɫ���������٣�Ϊ�˱������C���٣��ɲ�ȡ�ĸĽ���ʩ�� ______��
��4������ҺE���̷����壨FeSO47H2O������������� ______ �� ______ �� ______ ��ϴ�ӡ����
��5���ù���F�Ʊ�CuSO4��Һ���������ͼ3����;����д��;�����з�Ӧ�����ӷ���ʽ ______ ����ѡ������Ϊ�����;����˵��ѡ������� ______ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������̼������ȼ�ϵ��װ����ͼ��ʾ������˵���������
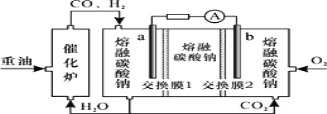
A.O2��b���õ��ӣ����ձ���ԭΪCO32
B.�ŵ�����У������ɵ缫a����������缫b
C.�õ�ع���ʱ��CO32��������Ĥ2������b��
D.H2����ĵ缫��ӦΪ��H22e+CO32=H2O+CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ԷϾ�Ǧ�����еĺ�Ǧ���ϣ�Pb��PbO��PbO2��PbSO4��̿�ڵȣ�Ϊԭ�ϣ��Ʊ���Ǧ��ʵ��Ǧ���������ã��乤��������ͼ1��ʾ��
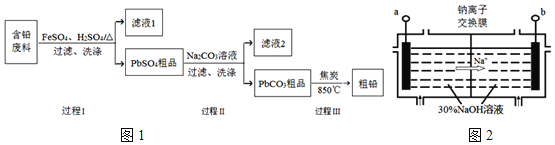
��֪��Ksp(PbSO4)=1.6��10-5��Ksp(PbCO3)=3.3��10-14��
��1�����̢��У���Fe2+���£�Pb��PbO2��Ӧ����PbSO4�Ļ�ѧ����ʽ��______��
��2�����̢��У�Fe2+�����̿ɱ�ʾΪ��
![]()
![]() ��
��
![]() д��ii�����ӷ���ʽ��______��
д��ii�����ӷ���ʽ��______��
![]() ����ʵ�鷽����֤ʵ���������̣���ʵ�鷽������������
����ʵ�鷽����֤ʵ���������̣���ʵ�鷽������������
![]() ���ữ��FeSO4��Һ�м���KSCN��Һ����Һ������ɫ���ټ�������PbO2����Һ��죮
���ữ��FeSO4��Һ�м���KSCN��Һ����Һ������ɫ���ټ�������PbO2����Һ��죮
![]() ______��
______��
��3�����̢��Ŀ������������Һ2��c(SO42-)=1.6molL-1��c(CO32-)=0.1molL-1����PbCO3��______![]() ����������������
����������������![]() ����PbSO4��
����PbSO4��
��4�������ӽ���Ĥ�����ⷨ�ǴӺ�Ǧ��������ȡǦ��һ���¹��գ���װ����ͼ2��ʾ������Ǧ����Ͷ�������ң���Ǧ�����е�PbSO4��NaOH��Һ������Ӧ��![]()
![]() ����ӵ�Դ��______��������
����ӵ�Դ��______��������
![]() �������У�PbO2��PbO��HPbO2-�������ŵ磬����PbO2�ŵ�ĵ缫��ӦʽΪ______��
�������У�PbO2��PbO��HPbO2-�������ŵ磬����PbO2�ŵ�ĵ缫��ӦʽΪ______��
![]() �봫ͳ��Ĥ�����ⷨ��ȣ�ʹ�������ӽ���Ĥ�������PbԪ�ص������ʣ�ԭ����______��
�봫ͳ��Ĥ�����ⷨ��ȣ�ʹ�������ӽ���Ĥ�������PbԪ�ص������ʣ�ԭ����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����(����)
A.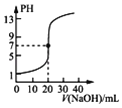 ��ʾ0.100 0 molL��1 NaOH��Һ�ζ�20.00 mL 0.100 0 molL��1������Һ�ĵζ�����
��ʾ0.100 0 molL��1 NaOH��Һ�ζ�20.00 mL 0.100 0 molL��1������Һ�ĵζ�����
B.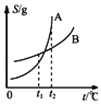 ��ʾA��B�����ʵ��ܽ�����¶ȱ仯�������t1��ʱA��B�ı�����Һ�ֱ�������t2��ʱ�����ʵ�����������(A)����(B)
��ʾA��B�����ʵ��ܽ�����¶ȱ仯�������t1��ʱA��B�ı�����Һ�ֱ�������t2��ʱ�����ʵ�����������(A)����(B)
C.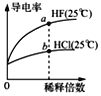 ��ͼ��֪��a��Kw����ֵ��b��Kw����ֵ��
��ͼ��֪��a��Kw����ֵ��b��Kw����ֵ��
D.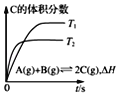 ��ʾ����ͬ���ܱ������У���ͬ�¶��µķ�Ӧ���÷�Ӧ����H��0
��ʾ����ͬ���ܱ������У���ͬ�¶��µķ�Ӧ���÷�Ӧ����H��0
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com