
【题目】为探索工业废料的再利用,某化学兴趣小组设计了如图1实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO47H2O)和胆矾晶体请回答:
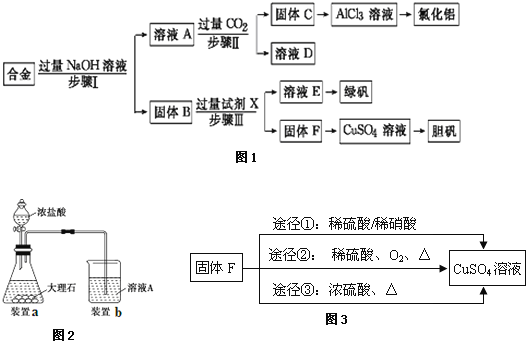
(1)写出步骤Ⅰ反应的离子方程式: ______ 。
(2)试剂X是 ______。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 ______。
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂制取CO2并将制得的气体通入溶液A中.一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少.为了避免固体C减少,可采取的改进措施是 ______。
(4)由溶液E到绿矾晶体(FeSO47H2O),所需操作是 ______ 、 ______ 、 ______ 、洗涤、干燥。
(5)用固体F制备CuSO4溶液,可设计如图3三种途径:写出途径①中反应的离子方程式 ______ ,请选出你认为的最佳途径并说明选择的理由 ______ 。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ 稀硫酸 过滤 在a、b之间添加盛放饱和NaHCO3溶液的洗气瓶 蒸发浓缩 冷却结晶 过滤 3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O 途径②最佳,理由是原料利用率高,环境污染小
【解析】
金属铁和金属铜不与氢氧化钠反应,铝可与氢氧化钠反应,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO47H2O)和胆矾晶体流程为:合金中铝、氧化铝与氢氧化钠反应,所得滤液A为NaAlO2溶液,经途径Ⅱ与足量二氧化碳发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,反应可生成氢氧化铝固体C,生成的氢氧化铝再和盐酸反应生成AlCl3,得到的AlCl3较纯净;溶液D为碳酸氢钠溶液;
滤渣B为Fe和Cu的化合物,加入足量稀硫酸,得到的滤液E为FeSO4,经蒸发浓缩、冷却结晶可得到绿矾,滤渣F为Cu,可用于制备胆矾,以此解答本题。
(1)步骤Ⅰ加过量的氢氧化钠,金属铝和氢氧化钠反应,金属铝溶解其中生成偏铝酸钠溶液,即2Al+2OH+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH+2H2O=2AlO2-+3H2↑;
(2)金属铁和金属铜不与氢氧化钠反应,金属铜和稀硫酸之间不反应,但是金属铁可以和稀硫酸之间反应生成硫酸亚铁和氢气,进而制的绿矾晶体,步骤Ⅰ、Ⅱ、Ⅲ均是固体和液体的分离操作,应该是过滤,
故答案为:稀硫酸;过滤;
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂将制得的CO2气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是二氧化碳气体中含有从盐酸中挥发出的氯化氢气体,氯化氢在水中溶解了部分沉淀氢氧化铝,发生的反应为Al(OH)3+3H+=Al3++3H2O,为了避免固体C减少,可在制取二氧化碳的收集装置中增加一个洗去氯化氢的装置,二氧化碳在饱和碳酸氢钠中不溶,氯化氢和碳酸氢钠反应生成二氧化碳气体,所以可在装置I和Ⅱ之间增加一个盛有饱和碳酸氢钠溶液的洗气瓶,除去二氧化碳中的氯化氢,
故答案为:在a、b之间添加盛放饱和NaHCO3溶液的洗气瓶;
(4)溶液E为FeSO4溶液,得到绿矾晶体(FeSO47H2O)的操作为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:蒸发浓缩;冷却结晶;过滤;
(5)金属铜可以和稀硝酸之间反应生成硝酸铜、一氧化氮和水,即3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,铜不能和稀硫酸反应,但是当加热并通入空气之后,铜和氧气反应生成氧化铜,然后氧化铜会和硫酸反应生成硫酸铜,不会产生污染大气的气体,该过程原料利用率高,且环境污染小,所以途径②最佳,
故答案为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;途径②最佳,理由是原料利用率高,环境污染小。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是( )
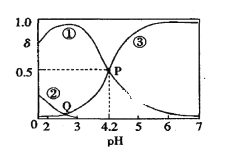
A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. 20℃时,H2C2O4的二级电离平衡常数Ka2=1×10-4.2
C. Q点对应溶液中lgc(H+)<lgc(OH-)
D. 0.100mol·L-1的NaHC2O4溶液中:c(OH-)=c(H+)-2c(C2O42-)+c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种综合处理SO2废气的工艺流程。下列说法正确的是

A.溶液酸性:A>B>C
B.溶液B转化为溶液C发生反应的离子方程式为4H++2Fe2++O2 =2Fe3++2H2O
C.向B溶液中滴加KSCN溶液,溶液可能会变为红色
D.加氧化亚铁可以使溶液C转化为溶液A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奈必洛尔是一种用于血管扩张的降血压药物,一种合成奈必洛尔中间体G的部分流程如下:
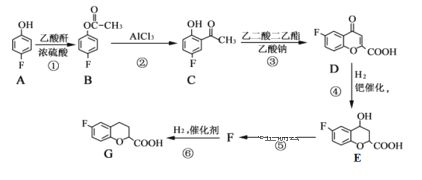
已知:乙酸酐的结构简式为![]()
请回答下列问题:
(1)A的名称是____________;B中所含官能团的名称是___________________。
(2)反应⑤的化学方程式为_____________,该反应的反应类型是______。
(3)G的分子式为_________,乙酸酐共面的原子最多有_____个
(4)写出同时满足下列条件的E的同分异构体的结构简式:_______。
a.苯环上只有三个取代基
b核磁共振氢谱图中只有4组吸收峰
c.1mol该物质与足量NaHCO3溶液反应生成2molCO2
(5)根据已有知识并结合相关信息,写出以![]() 和乙酸酐为原料制备
和乙酸酐为原料制备 的合成路线流程图________________(无机试剂任选),合成路线流程图示例如下: CH3CH2Br
的合成路线流程图________________(无机试剂任选),合成路线流程图示例如下: CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒奶粉中发现的化工原料三聚氰胺可以由下列反应合成:CaO+3C![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2![]() CaCN2+C,CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CaCN2+C,CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)基态钙原子电子占据的最高能层符号是_________,其核外共有______种不同能量的电子。
(2)CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O,由此可以推知CN22-的空间构型为________。
(3)1mol尿素分子[CO(NH2)2]中含有的π键与σ键的数目之比为_________;所含元素的电负性由大到小的顺序为_____________。
(4)三聚氰胺俗称“蛋白精”,其结构为:
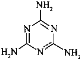
其中氮原子的杂化方式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对制革工业污泥中铬的处理工艺流程如下:
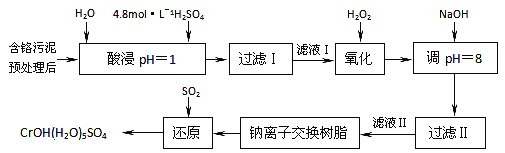
已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有_________、___________。(答出两点)。
(2)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — |
沉淀完全时的pH | 3.7 | 5.4(>8溶解) | 9(>9溶解) |
①用NaOH调节溶液的pH不能超过8,其理由是________________________________。
②常温下,当pH=8时,Mg2+是否开始沉淀(溶液中镁离子浓度不超过1mol·L-1)___________ 。 (填“是”或“否”)若要使Mg2+完全沉淀,溶液的pH至少为_________(已知Ksp[Mg(OH)2]=1. 6×10-12,lg2=0.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O=O键的键焓分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1,请写出水蒸气分解的热化学方程式__________。
II.甲醇(CH3OH)广泛用作燃料电池的燃料,可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)下图是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
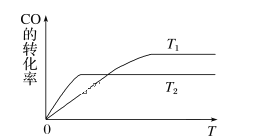
①T1____T2(填“>”“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1____(填“>”“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是______(填字母)。
a. 降低温度 b. 将CH3OH(g)从体系中分离
c. 使用合适的催化剂 d. 充入He,使体系总压强增大
(2)在容积为1 L的恒容容器中,分别研究在300 ℃、350 ℃和370 ℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线x对应的温度是______℃;曲线z对应的温度下上述反应的化学平衡常数为______。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为___________。
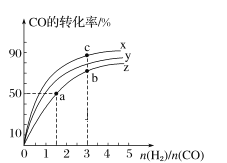
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。关于常温下pH=2的H3PO4溶液,下列说法正确的是( )
A. 加水稀释使电离度增大,溶液pH减小
B. 每升溶液中的H+数目为0.02NA
C. 加入NaH2PO4固体,溶液酸性增强
D. c(H+)=c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
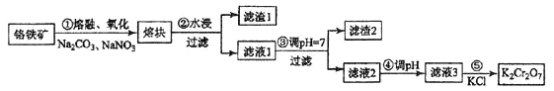
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com