
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,实现铅的再生利用.其工作流程如图1所示:
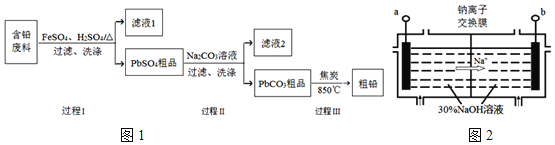
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是______.
(2)过程Ⅰ中,Fe2+催化过程可表示为:
![]()
![]() .
.
![]() 写出ii的离子方程式:______.
写出ii的离子方程式:______.
![]() 下列实验方案可证实上述催化过程.将实验方案补充完整.
下列实验方案可证实上述催化过程.将实验方案补充完整.
![]() 向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红.
向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红.
![]() ______.
______.
(3)过程Ⅱ的目的是脱硫.若滤液2中c(SO42-)=1.6molL-1,c(CO32-)=0.1molL-1,则PbCO3中______![]() 填“是”或“否”
填“是”或“否”![]() 混有PbSO4.
混有PbSO4.
(4)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图2所示.将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发生反应:![]()
![]() 与外接电源的______极相连.
与外接电源的______极相连.
![]() 电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为______.
电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为______.
![]() 与传统无膜固相电解法相比,使用钠离子交换膜可以提高Pb元素的利用率,原因是______.
与传统无膜固相电解法相比,使用钠离子交换膜可以提高Pb元素的利用率,原因是______.
【答案】![]() 4
4![]()
![]()
![]() 取a中红色溶液少量,加入足量Pb,充分反应后,红色褪去 否 负
取a中红色溶液少量,加入足量Pb,充分反应后,红色褪去 否 负 ![]() 阻止HPbO2-进入阳极室被氧化
阻止HPbO2-进入阳极室被氧化
【解析】
(1)在催化下,Pb、PbO2和H2SO4反应生成PbSO4和水,据此书写反应方程式;
(2)①根据题给信息知反应i中Fe2+被PbO2氧化为Fe3+,则反应ii中Fe3+被Pb还原为Fe2+,据此书写离子方程式;
②加入过量的Pb平衡逆向进行充分反应后,红色褪去;
(3)根据Ksp(PbCO3)=3.3×10-14和c(CO32-)=0.1molL-1计算出c(Pb2+)利用浓度积Qc和Ksp(PbSO4)之间的大小关系确定PbCO3中是否混有PbSO4;
(4)①根据钠离子的移动方向确定阴阳极;
②电解过程中,PbO2在阴极得电子,发生还原反应;
③钠离子交换膜只允许钠离子通过。
(1)根据题给化学工艺流程知,过程Ⅰ中,在催化下,Pb、PbO2和H2SO4反应生成PbSO4和水,化学方程式为:![]()
![]()
![]() ;
;
(2)①催化剂通过参加反应,改变反应历程,降低反应的活化能,加快化学反应速率,而本身的质量和化学性质反应前后保持不变,根据题给信息知反应i中Fe2+被PbO2氧化为Fe3+,则反应ii中Fe3+被Pb还原为Fe2+,离子方程式为:![]() ;
;
②a实验证明发生反应i,则b实验需证明发生反应ii,实验方案为:
![]() 向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红,亚铁离子被氧化为铁离子,
向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红,亚铁离子被氧化为铁离子,
![]() 取a中红色溶液少量,溶液中存在平衡,
取a中红色溶液少量,溶液中存在平衡,![]() ,加入过量Pb,和平衡状态下铁离子反应生成亚铁离子,平衡逆向进行充分反应后,红色褪去,
,加入过量Pb,和平衡状态下铁离子反应生成亚铁离子,平衡逆向进行充分反应后,红色褪去,
(3)因为Ksp(PbCO3)=3.3×10-14和c(CO32-)=0.1molL-1,可知c(Pb2+)=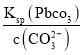 =
=![]() mol/L=3.3×10-13 mol/L , 因此Qc= c(Pb2+) c(SO42-)=3.3×10-13×1.6=5.28×10-13< Ksp(PbSO4),说明PbSO4在母液中未饱和,即PbCO3中不混有PbSO4;
mol/L=3.3×10-13 mol/L , 因此Qc= c(Pb2+) c(SO42-)=3.3×10-13×1.6=5.28×10-13< Ksp(PbSO4),说明PbSO4在母液中未饱和,即PbCO3中不混有PbSO4;
(4)①根据钠离子向阴极移动知,b为阴极,与电源负极相连;
②电解过程中,PbO2在阴极得电子,发生还原反应,电极反应式为![]() ;
;
③钠离子交换膜只允许钠离子通过,阻止HPbO2-进入阳极室被氧化,从而提高Pb元素的利用率;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在![]() 时,向
时,向![]() 溶液滴加入
溶液滴加入![]() 的盐酸,滴定曲线如图1所示,CN-、HCN浓度所占分数
的盐酸,滴定曲线如图1所示,CN-、HCN浓度所占分数![]() 随pH变化的关系如图2所示,下列表述正确的是
随pH变化的关系如图2所示,下列表述正确的是![]()

A.b点时,溶液中微粒浓度大小的关系:![]()
B.d点溶液垂直的关系:![]()
C.图2中的e点对应图1中的c点
D.在滴定过程中选用酚酞试剂比选用甲基橙试剂作指示剂误差更小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒奶粉中发现的化工原料三聚氰胺可以由下列反应合成:CaO+3C![]() CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2![]() CaCN2+C,CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CaCN2+C,CaCN2+2H2O=NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)基态钙原子电子占据的最高能层符号是_________,其核外共有______种不同能量的电子。
(2)CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O,由此可以推知CN22-的空间构型为________。
(3)1mol尿素分子[CO(NH2)2]中含有的π键与σ键的数目之比为_________;所含元素的电负性由大到小的顺序为_____________。
(4)三聚氰胺俗称“蛋白精”,其结构为:
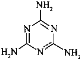
其中氮原子的杂化方式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O=O键的键焓分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1,请写出水蒸气分解的热化学方程式__________。
II.甲醇(CH3OH)广泛用作燃料电池的燃料,可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
(1)下图是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
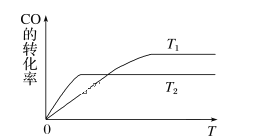
①T1____T2(填“>”“<”或“=”)。T1和T2温度下的平衡常数大小关系是K1____(填“>”“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是______(填字母)。
a. 降低温度 b. 将CH3OH(g)从体系中分离
c. 使用合适的催化剂 d. 充入He,使体系总压强增大
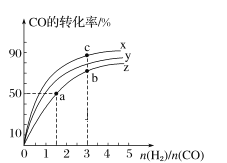
(2)在容积为1 L的恒容容器中,分别研究在300 ℃、350 ℃和370 ℃三种温度下合成甲醇的规律。如图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线x对应的温度是______℃;曲线z对应的温度下上述反应的化学平衡常数为______。曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO(g)与H2O(g)反应的能量变化如图所示,有关两者反应的说法正确的是

A.该反应为吸热反应
B.1 mol CO(g)和1 mol H2O(g)具有的总能量大于1 mol CO2(g)和1 mol H2(g)具有的总能量
C.该反应不需要加热就能进行
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。关于常温下pH=2的H3PO4溶液,下列说法正确的是( )
A. 加水稀释使电离度增大,溶液pH减小
B. 每升溶液中的H+数目为0.02NA
C. 加入NaH2PO4固体,溶液酸性增强
D. c(H+)=c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下(20oC))课外小组用下列装置探究铁和硝酸反应情况,过程如下图所示:

将Ⅲ中液面上的气体排入小试管中点燃,有尖锐爆鸣声,小试管壁出现液滴。取反应后溶液,加入足量NaOH 溶液得到灰绿色沉淀。煮沸时,蒸气带有刺激性气味并能使湿润红色石蕊试纸变蓝。
(1)X气体是______ (填化学式),证据是________。
(2)实验中硝酸被还原成另一种产物的化学方程式_____。
(3)甲同学对产生的气体原因提出假设并设计方案:
假设1:该浓度的硝酸中H+的氧化性大于NO3-
假设2:H+还原反应速率大于NO3-的还原反应速率
I. 验证假设1:可用____(选 “ Cu” 或“Zn”)粉与同浓度硝酸反应,依据 ____________ ,则假设1不成立。
II. 验证假设2:改变条件重复上图过程实验,结果如下:(所用试剂的量、气体成分与实验上图相同)
序号 | 反应温度 | 实验结果 |
a | 40oC | 溶液浅绿色,收集气体为3.4mL |
b | 60oC | 溶液浅绿色,收集气体为2.6mL |
上表实验结果_____(填“能”或“否”)判断假设2成立。由实验数据结果分析温度对铁粉与硝酸反应时对生成X体积的影响的原因___________。
(4)常温下(20℃),乙同学改用3mol·L–1 HNO3 进行图1过程实验,Ⅱ中仍为无色气体,在Ⅲ中气体变红色。由此得出的相关结论正确的是______ 。
a. 该实验产生的无色气体只有NO
b. 若改用浓硝酸时,反应会更剧烈还原产物为NO2
c. 硝酸的浓度不同时,其主要还原产物不同
(5)综上所述,金属与硝酸生成X气体,需要控制的条件是___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
③CH3OH(g)![]() CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
(1)已知反应②中相关化学键键能数据如下:
化学键 | H-H | C=O | C≡O | H-O |
E/kJ·mol-1 | 436 | 803 | 1076 | 465 |
由此计算ΔH2=____kJ·mol-1。已知ΔH3=+99kJ·mol-1,则ΔH1=____kJ·mol-1。
(2) 一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
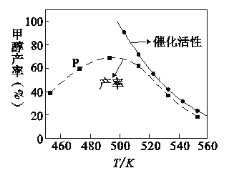
①温度为470K时,图中P点____(填“是”或“不是”)处于平衡状态,490K之后,甲醇产率随温度升高而减小的原因除了升高温度使反应①平衡逆向移动以外,还有___________________________________________________________、______________________________________________________________________。
②一定能提高甲醇产率的措施是______。
A.增大压强 B.升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)如图为一定比例的CO2+H2,CO+H2、CO/CO2+H2条件下甲醇生成速率与温度的关系。
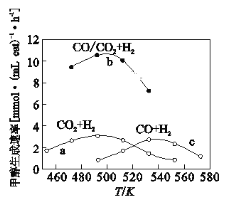
①490K时,根据曲线a、c判断合成甲醇的反应机理是______(填I或II)
Ⅰ.CO2![]() CO
CO![]() CH3OH
CH3OH
II.CO![]() CO2
CO2![]() CH3OH+H2O
CH3OH+H2O
②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从平衡移动的角度,结合反应①、②分析原因___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25℃ 时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )

A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.碳酸钠溶液中滴加少量氯水,反应的离子方程式为![]() +Cl2+H2O=
+Cl2+H2O=![]() +Cl-+ClO-
+Cl-+ClO-
C.向0.1mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
D.向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3溶液,![]() 先形成沉淀
先形成沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com