
【题目】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
③CH3OH(g)![]() CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
(1)已知反应②中相关化学键键能数据如下:
化学键 | H-H | C=O | C≡O | H-O |
E/kJ·mol-1 | 436 | 803 | 1076 | 465 |
由此计算ΔH2=____kJ·mol-1。已知ΔH3=+99kJ·mol-1,则ΔH1=____kJ·mol-1。
(2) 一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
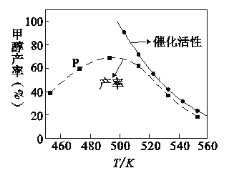
①温度为470K时,图中P点____(填“是”或“不是”)处于平衡状态,490K之后,甲醇产率随温度升高而减小的原因除了升高温度使反应①平衡逆向移动以外,还有___________________________________________________________、______________________________________________________________________。
②一定能提高甲醇产率的措施是______。
A.增大压强 B.升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)如图为一定比例的CO2+H2,CO+H2、CO/CO2+H2条件下甲醇生成速率与温度的关系。
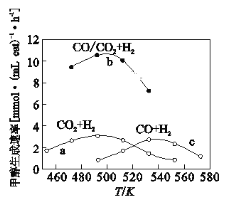
①490K时,根据曲线a、c判断合成甲醇的反应机理是______(填I或II)
Ⅰ.CO2![]() CO
CO![]() CH3OH
CH3OH
II.CO![]() CO2
CO2![]() CH3OH+H2O
CH3OH+H2O
②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从平衡移动的角度,结合反应①、②分析原因___________________________。
【答案】+36 —63 不是 升高温度使反应③平衡正向移动 催化剂活性降低 AC Ⅱ CO促进反应②逆向移动,使反应①中CO和H2的量增加,水蒸气的量减少
【解析】
(1)盖斯定律的应用、根据键能计算反应热;
(2)勒夏特列定理的应用以及条件的选择;
(1)CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=反应物的总键能-生成物的总键能,带入数据,
CO(g)+H2O(g) ΔH2=反应物的总键能-生成物的总键能,带入数据,![]() ;根据盖斯定律,反应①=②-③,ΔH1=ΔH2-ΔH3=+36-99kJ/mol=-63 kJ/mol;答案为+36 -63;
;根据盖斯定律,反应①=②-③,ΔH1=ΔH2-ΔH3=+36-99kJ/mol=-63 kJ/mol;答案为+36 -63;
(2)P点不处于平衡状态。在490K之前,甲醇产率随着温度升高而增大的原因是温度越高化学反应速率越快,没有达到平衡前,一直向平衡状态移动,产率一直增大;在490K之后,产率下降,从图中可以看出来,催化剂的活性降低,且由于温度越高,反应①平衡逆向移动,此外反应③时吸热反应,温度越高,正向移动,甲醇的产率也降低;要提高甲醇的产率使反应正向移动,而反应催化剂活性要好,A增大压强,反应①平衡正向移动,而且反应③逆向移动,有利于增加甲醇的产率,A符合题意;B升高温度,从图可知,B不符合题意;C选择合适催化剂,选择生成甲醇,减少反应②的发生,提高甲醇的产率,C符合题意;D加入大量催化剂,催化剂不改变平衡,不会影响甲醇的转化率,D不符合题意。答案为不是 升高温度使反应③平衡正向移动 催化剂活性降低 AC;
(3)①490K时,从甲醇的生成速率比较,a曲线大于c曲线,即甲醇来源于CO2和H2,故490K时,合成甲醇的机理为Ⅱ;②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,对反应②,CO是生成物,CO促使反应②逆向移动,CO2和H2的量增加,水蒸气的量减少,反应①正向进行,故CO的存在使甲醇生成速率增大。答案为Ⅱ CO促进反应②逆向移动,使反应①中CO和H2的量增加,水蒸气的量减少。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】“除氢气外,烃、肼、甲醇、氨、煤气等液体或气体,均可作燃料电池的燃料”。已知肼燃烧时发生下列反应,N2H4+O2![]() N2+2H2O。以Pt为电极,以硫酸为电解质溶液组成肼燃料电池,下列关于肼燃料电池的说法中不正确是 )
N2+2H2O。以Pt为电极,以硫酸为电解质溶液组成肼燃料电池,下列关于肼燃料电池的说法中不正确是 )
A. 肼是燃料电池的负极反应物,O2是正极反应物
B. 肼燃料电池的正极反应为 O2 + 2H2O + 4e-= 4OH-
C. 肼燃料电池的负极反应为:N2H4 —4e—=N2↑+4H+
D. 电池工作过程中H+向正极移动,但H+物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,实现铅的再生利用.其工作流程如图1所示:
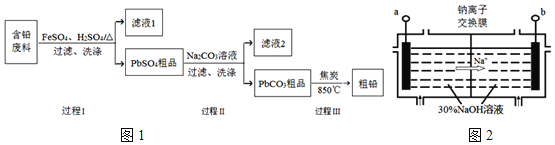
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是______.
(2)过程Ⅰ中,Fe2+催化过程可表示为:
![]()
![]() .
.
![]() 写出ii的离子方程式:______.
写出ii的离子方程式:______.
![]() 下列实验方案可证实上述催化过程.将实验方案补充完整.
下列实验方案可证实上述催化过程.将实验方案补充完整.
![]() 向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红.
向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红.
![]() ______.
______.
(3)过程Ⅱ的目的是脱硫.若滤液2中c(SO42-)=1.6molL-1,c(CO32-)=0.1molL-1,则PbCO3中______![]() 填“是”或“否”
填“是”或“否”![]() 混有PbSO4.
混有PbSO4.
(4)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图2所示.将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发生反应:![]()
![]() 与外接电源的______极相连.
与外接电源的______极相连.
![]() 电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为______.
电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为______.
![]() 与传统无膜固相电解法相比,使用钠离子交换膜可以提高Pb元素的利用率,原因是______.
与传统无膜固相电解法相比,使用钠离子交换膜可以提高Pb元素的利用率,原因是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是

A.反应开始到10s,用Z表示的平均反应速率为0.158 mol/(L·s)
B.反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C.反应的化学方程式为:X(g)+Y(g)![]() Z(g)
Z(g)
D.反应开始到10s时,Y的转化率为79.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是典型的半导体材料,在光照射下导电性可提高近千倍。下图是从某工厂的硒化银半导体废料(含Ag2Se、Cu单质)中提取硒、银的工艺流程图:

回答下列问题:
(1)为提高反应①的浸出速率,可采用的措施为____(答出两条)。
(2)已知反应③生成一种可参与大气循环的气体单质,写出该反应的离子方程式____。
(3)反应②为Ag2SO4(s)+2Cl-(aq)=2AgCl(s)+SO42-(aq);常温下的Ag2SO4、AgCl的饱和溶液中阳离子和阴离子浓度关系如图所示。则Ag2SO4(s)+2Cl-(aq)=2AgCl(s)+SO42-(aq)的化学平衡常数的数量级为____。

(4)写出反应④的化学方程式____。
(5)室温下,H2SeO3水溶液中H2SeO3、HSeO3-、SeO32-的摩尔分数随pH的变化如图所示,则室温下H2SeO3的Ka2=___。
(6)工业上粗银电解精炼时,电解液的pH为1.5~2,电流强度为5~10A,若电解液pH太小,电解精炼过程中在阴极除了银离子放电,还会发生____(写电极反应式),若用10A的电流电解60min后,得到32.4gAg,则该电解池的电解效率为____%。(保留小数点后一位。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应mA(s)+nB(g)![]() eC(g)+fD(g),当其他条件不变时,C的体积分数[φ(C)]在不同温度(T)和不同压强(p)下随时间(t)的变化关系如图所示。下列叙述正确的是( )
eC(g)+fD(g),当其他条件不变时,C的体积分数[φ(C)]在不同温度(T)和不同压强(p)下随时间(t)的变化关系如图所示。下列叙述正确的是( )
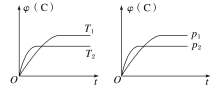
A.达到平衡后,若使用催化剂,C的体积分数将增大
B.该反应的ΔH<0
C.化学方程式中,n>e+f
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.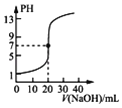 表示0.100 0 molL﹣1 NaOH溶液滴定20.00 mL 0.100 0 molL﹣1醋酸溶液的滴定曲线
表示0.100 0 molL﹣1 NaOH溶液滴定20.00 mL 0.100 0 molL﹣1醋酸溶液的滴定曲线
B.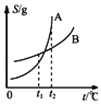 表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数ω(A)>ω(B)
表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数ω(A)>ω(B)
C.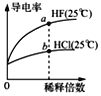 由图可知,a点Kw的数值比b点Kw的数值大
由图可知,a点Kw的数值比b点Kw的数值大
D.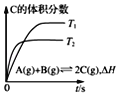 表示在相同的密闭容器中,不同温度下的反应,该反应的△H<0
表示在相同的密闭容器中,不同温度下的反应,该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NxOy、CO、SO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)![]() 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式_____________________,该热化学方程式的平衡常数K=______________________(用K1、K2、K3表示)
(2)直接排放含SO2的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X与溶液pH的关系如图所示。
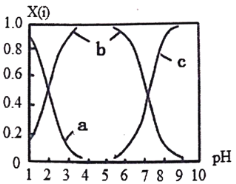
①测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是___________。
②向 NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降低,用化学平衡移动原理解释溶液pH降低的原因________________________。
(3)在一定温度下的恒容容器中,反应2N2O(g)![]() 2N2(g)+O2(g)的部分实验数据如下:
2N2(g)+O2(g)的部分实验数据如下:
反应时 间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O) /(mol/L) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
①在0~40min时段,反应速率v(N2O)为___________mol/(L·min)。
②若N2O起始浓度c0为0.150 mol/L,则反应至30mn时N2O的转化率a=___________。
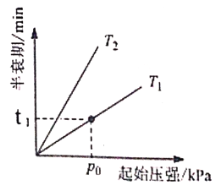
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___________T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=___________(用p0表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2010年,中国首次应用六炔基苯在铜片表面合成了石墨炔薄膜(其合成示意图如右图所示),其特殊的电子结构将有望广泛应用于电子材料领域。下列说法不正确的是( )
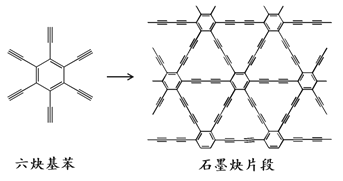
A.六炔基苯的化学式为C18H6
B.六炔基苯和石墨炔都具有平面型结构
C.六炔基苯和石墨炔都可发生加成反应
D.六炔基苯合成石墨炔属于加聚反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com