
����Ŀ������������ȷ����(����)
A.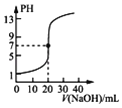 ��ʾ0.100 0 molL��1 NaOH��Һ�ζ�20.00 mL 0.100 0 molL��1������Һ�ĵζ�����
��ʾ0.100 0 molL��1 NaOH��Һ�ζ�20.00 mL 0.100 0 molL��1������Һ�ĵζ�����
B.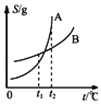 ��ʾA��B�����ʵ��ܽ�����¶ȱ仯�������t1��ʱA��B�ı�����Һ�ֱ�������t2��ʱ�����ʵ�����������(A)����(B)
��ʾA��B�����ʵ��ܽ�����¶ȱ仯�������t1��ʱA��B�ı�����Һ�ֱ�������t2��ʱ�����ʵ�����������(A)����(B)
C.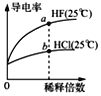 ��ͼ��֪��a��Kw����ֵ��b��Kw����ֵ��
��ͼ��֪��a��Kw����ֵ��b��Kw����ֵ��
D.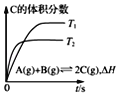 ��ʾ����ͬ���ܱ������У���ͬ�¶��µķ�Ӧ���÷�Ӧ����H��0
��ʾ����ͬ���ܱ������У���ͬ�¶��µķ�Ӧ���÷�Ӧ����H��0
���𰸡�D
��������
A.��ΪCH3COONa��Һ�ʼ��ԣ�������Һ������ʱ���ζ�����NaOH�����С��20mL��A����
B.��Ϊ�¶ȸı䣬A��B����Һ�������������䣬t1ʱB���ܽ�ȴ���A������������B>A��t2ʱ��������ҲӦΪB>A��B����
C.a���b����¶ȶ���25����ˮ�����ӻ�Kw��ͬ��C����
D.T2��ƽ���ʱ���T1�̣�����T2>T1���¶����ߣ�C�����������С�������ƽ�������ƶ�������ӦΪ���ȷ�Ӧ���÷�Ӧ�ġ�H��0��D��ȷ��
��ѡD��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����̷��з��ֵĻ���ԭ�������谷���������з�Ӧ�ϳɣ�CaO��3C![]() CaC2��CO����CaC2��N2
CaC2��CO����CaC2��N2![]() CaCN2��C��CaCN2��2H2O=NH2CN��Ca(OH)2��NH2CN��ˮ��Ӧ��������[CO(NH2)2]�����غϳ������谷��
CaCN2��C��CaCN2��2H2O=NH2CN��Ca(OH)2��NH2CN��ˮ��Ӧ��������[CO(NH2)2]�����غϳ������谷��
(1)��̬��ԭ�ӵ���ռ�ݵ�����ܲ������_________��������______�ֲ�ͬ�����ĵ��ӡ�
(2)CaCN2��������ΪCN22-����CN22-��Ϊ�ȵ�����ķ�����N2O���ɴ˿�����֪CN22-�Ŀռ乹��Ϊ________��
(3)1mol���ط���[CO(NH2)2]�к��е���������������Ŀ֮��Ϊ_________������Ԫ�صĵ縺���ɴ�С��˳��Ϊ_____________��
(4)�����谷�׳�������������ṹΪ��
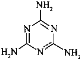
���е�ԭ�ӵ��ӻ���ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(20oC))����С��������װ��̽���������ᷴӦ�������������ͼ��ʾ��

������Һ���ϵ���������С�Թ��е�ȼ���м���������С�Թܱڳ���Һ�Ρ�ȡ��Ӧ����Һ����������NaOH ��Һ�õ�����ɫ���������ʱ���������д̼�����ζ����ʹʪ���ɫʯ����ֽ������
(1)X������______ (�ѧʽ)��֤����________��
(2)ʵ�������ᱻ��ԭ����һ�ֲ���Ļ�ѧ����ʽ_____��
(3)��ͬѧ�Բ���������ԭ��������貢��Ʒ�����
����1����Ũ�ȵ�������H+�������Դ���NO3-
����2��H+��ԭ��Ӧ���ʴ���NO3-�Ļ�ԭ��Ӧ����
I. ��֤����1������____(ѡ �� Cu�� ����Zn��)����ͬŨ�����ᷴӦ������ ____________ �������1��������
II. ��֤����2���ı������ظ���ͼ����ʵ�飬������£�(�����Լ�����������ɷ���ʵ����ͼ��ͬ)
��� | ��Ӧ�¶� | ʵ���� |
a | 40oC | ��Һdz��ɫ���ռ�����Ϊ3.4mL |
b | 60oC | ��Һdz��ɫ���ռ�����Ϊ2.6mL |
�ϱ�ʵ����_____(����������������)�жϼ���2��������ʵ�����ݽ�������¶ȶ����������ᷴӦʱ������X�����Ӱ���ԭ��___________��
(4)������(20��)����ͬѧ����3mol��L�C1 HNO3 ����ͼ1����ʵ�飬������Ϊ��ɫ���壬�ڢ���������ɫ���ɴ˵ó�����ؽ�����ȷ����______ ��
a. ��ʵ���������ɫ����ֻ��NO
b. ������Ũ����ʱ����Ӧ������һ�ԭ����ΪNO2
c. �����Ũ�Ȳ�ͬʱ������Ҫ��ԭ���ﲻͬ
(5)������������������������X���壬��Ҫ���Ƶ�������___________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ���ԭ�ϡ����úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2)�ڴ����������ºϳɼ״������ܷ����ķ�Ӧ���£�
��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)����H1
CH3OH(g)+H2O(g)����H1
��CO2(g)+H2(g)![]() CO(g)+H2O(g)����H2
CO(g)+H2O(g)����H2
��CH3OH(g)![]() CO(g)+2H2(g)����H3
CO(g)+2H2(g)����H3
��1����֪��Ӧ������ػ�ѧ�������������£�
��ѧ�� | H��H | C��O | C��O | H��O |
E/kJ��mol��1 | 436 | 803 | 1076 | 465 |
�ɴ˼�����H2��____kJ��mol��1����֪��H3����99kJ��mol��1������H1��____kJ��mol��1��
��2�� һ�������ĺϳ�����װ�д����ķ�Ӧ���з�Ӧ12Сʱ����ϵ�м״��IJ��ʺʹ����Ĵ��������¶ȵĹ�ϵ��ͼ��ʾ��
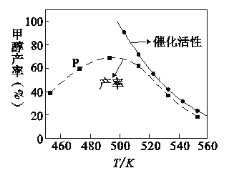
���¶�Ϊ470Kʱ��ͼ��P��____(������������������)����ƽ��״̬��490K֮�״��������¶����߶���С��ԭ����������¶�ʹ��Ӧ��ƽ�������ƶ����⣬����___________________________________________________________��______________________________________________________________________��
��һ������״����ʵĴ�ʩ��______��
A������ѹǿ B�������¶� C��ѡ����ʴ��� D�������������
��3����ͼΪһ��������CO2+H2��CO+H2��CO/CO2+H2�����¼״������������¶ȵĹ�ϵ��
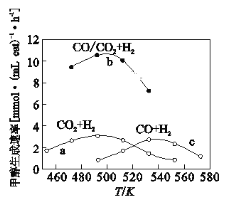
��490Kʱ����������a��c�жϺϳɼ״��ķ�Ӧ������______(��I��II)
����CO2![]() CO
CO![]() CH3OH
CH3OH
II��CO![]() CO2
CO2![]() CH3OH��H2O
CH3OH��H2O
��490Kʱ������a������b��ȣ�CO�Ĵ���ʹ�״�������������ƽ���ƶ��ĽǶȣ���Ϸ�Ӧ�١��ڷ���ԭ��___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Na��Na2O��Na2O2�Ļ������������ˮ��Ӧ���ڱ�״���µõ�a L������塣���û������ͨ�������ȼ��ǡ����ȫ��Ӧ����ԭ�������Na��Na2O��Na2O2�����ʵ���֮�ȿ���Ϊ
A. 2��1��1
B. 1��1��2
C. 1��2��1
D. 4��3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ظ������һ����Ҫ�Ļ���ԭ�ϣ�һ���ɸ������Ʊ������������Ҫ�ɷ�ΪFeO��Cr2O3�������й衢�������ʡ��Ʊ�������ͼ��ʾ��
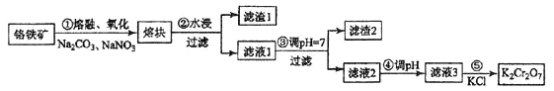
�ش��������⣺
��1������ٵ���Ҫ��ӦΪ��FeO��Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
������Ӧ��ƽ��FeO��Cr2O3��NaNO3��ϵ����Ϊ__________���ò��費��ʹ���մ�������ԭ����________________��
��2������1�к������Ľ���Ԫ����____________������2����Ҫ�ɷ���_____________���������ʡ�
��3������ܵ���Һ2��pHʹ֮��____________�����С������ԭ����___________________�������ӷ���ʽ��ʾ����
��4���й����ʵ��ܽ����ͼ��ʾ������Һ3���м�������KCl������Ũ������ȴ�ᾧ�����˵õ�K2Cr2O7���塣��ȴ��___________�����ţ��õ���K2Cr2O7�����Ʒ��ࡣ

a��80�� b��60�� c��40�� d��10��
����ݵķ�Ӧ������___________________��
��5��ij������m1 kg ������ۣ���Cr2O3 40%���Ʊ�K2Cr2O7�����յõ���Ʒ m2 kg������Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]
ͭ���ء����Ԫ���γɵĻ��������ִ���ҵ���й㷺����;���ش��������⣺
��1����̬ͭԭ�ӵĺ������ռ�е��ܼ���Ϊ________�������Ϊ________��
��2������Ԫ�������ɣ�ԭ�Ӱ뾶Ga________As����һ������Ga________As��������ڡ���С�ڡ���
��3��AsCl3���ӵ����幹��Ϊ________������As���ӻ��������Ϊ________��
��4��ͭ��CN-���γ��������[Cu��CN-��4]2-��д��һ����CN-�ȵ�����ķ��ӻ�ѧʽ________������[Cn��CN-��4]2-�ж���CN-��ΪCl-��ֻ��һ�ֽṹ����[Cu��CN-��4]2-��4����ԭ�������ռ�λ�ù�ϵΪ________��
��5��GaAs���۵�Ϊ1238C���ܶ�Ϊp g��cm-3���侧���ṹ��ͼ��ʾ���þ��������Ϊ________��Ga��As��________�����ϡ�Ga��As��Ħ�������ֱ�ΪMGag��mol-1��MAsg��mol-1��ԭ�Ӱ뾶�ֱ�ΪrGa pm��rAs pm�������ӵ�����ֵΪNA����GaAs������ԭ�ӵ����ռ��������İٷ���Ϊ________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���25�� ʱijЩ�ε��ܶȻ�����������ĵ���ƽ�ⳣ��������˵����ȷ����( )

A.��ͬŨ��CH3COONa��NaClO�Ļ��Һ�У�������Ũ�ȵĴ�С��ϵ��c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.̼������Һ�еμ�������ˮ����Ӧ�����ӷ���ʽΪ![]() +Cl2+H2O=
+Cl2+H2O=![]() +Cl-+ClO-
+Cl-+ClO-
C.��0.1mol��L-1 CH3COOH��Һ�еμ�NaOH��Һ��c(CH3COOH):c(CH3COO-)=5:9����ʱ��ҺpH=5
D.��Ũ�Ⱦ�Ϊ1��10-3mol��L-1��KCl��K2CrO4���Һ�еμ�1��10-3mol��L-1��AgNO3��Һ��![]() ���γɳ���
���γɳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���Դ�ḻ���۸��������һ����Ҫ�Ļ���ԭ�ϣ����ŷdz���Ҫ���㷺����;����ҵ�ϳ���ˮú���ں��ݡ������ͼ��ȵ������������״������Ȼ�ѧ����ʽΪ��2H2(g)+CO(g) ![]() CH3OH(g);��H=-90.8kJ/mol��
CH3OH(g);��H=-90.8kJ/mol��
��1���÷�Ӧ��ƽ�ⳣ������ʽΪ��K=____���������¶ȣ�Kֵ��______�������С�䣩��
��2�����¸�����˵���÷�Ӧ�ﵽƽ��״̬����____________.
A.���������ܶȱ��ֲ��� B.�״��������������ֲ���
C.CO��Ũ�ȱ��ֲ��� D.2v��(H2)=v��(CH3OH)
��3����210��C��240��C��270��C���ֲ�ͬ�¶ȡ�2 L�����ܱ��������о��ϳɼ״��Ĺ��ɡ�
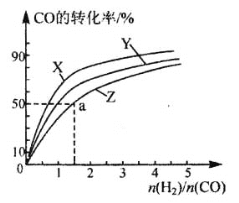
��ͼ�����������¶��²�ͬ��H2��CO����ʼ��ɱȣ���ʼʱCO�����ʵ�����Ϊ1 mol)��COƽ��ת���ʵĹ�ϵ��������Z��Ӧ���¶���_____������ʼ�ﵽa������ʱ��Ϊ5min����H2�ķ�Ӧ����Ϊ:_______________mol/(L��min)��
��4��ij��ȤС���������ͼ��ʾ�ļ״�ȼ�ϵ��װ�á�
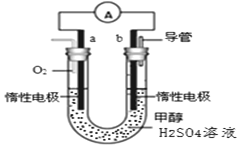
���õ�ع���ʱ��������____________��������a���� ��b������
���õ�ظ�����Ӧ�����ӷ���ʽΪ____________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com