
【题目】如图,A、B、C、D、E是元素周期表中的5种主族元素。下列说法不正确的是( )

A. A、E原子序数之差可能为2
B. D、E原子序数之差可能是8、18或32
C. B、C原子序数之差一定是2
D. B、D原子序数之差不可能是7
科目:高中化学 来源: 题型:
【题目】下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A.浓硫酸使胆矾晶体变白(脱水性)
B.在加热条件下铜与浓硫酸反应(氧化性、酸性)
C.蔗糖与浓硫酸反应中有海棉状的炭生成(吸水性)
D.浓硫酸可用来干燥某些气体(不挥发性)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关天然产物水解的叙述不正确的是
A. 纤维素水解与淀粉水解得到的最终产物不同
B. 可用碘检验淀粉水解是否完全
C. 蛋白质水解的最终产物均为氨基酸
D. 油脂水解可得到丙三醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】200 mL 1 mol/L的氯化铝溶液中加入一定体积的2 mol/L的NaOH溶液,最终产生7.8 g沉淀,则加入的NaOH溶液的体积可能是( )
① 350 mL ② 90 mL ③ 150 mL ④200 mL
A. 只有① B. ①③ C. ②④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)性能优越,被称为继铁、铝制后的“第三金属”。工业上以金红石为原料制取Ti的反应为:
aTiO2+bCl2+cC ![]() aTiCl4+cCO ……反应I
aTiCl4+cCO ……反应I
TiCl4+2Mg![]() Ti+2MgCl2 ……反应II
Ti+2MgCl2 ……反应II
关于反应I、II的分析不正确的是 ( )
① TiCl4在反应I中是还原产物,在反应II中是氧化剂;
② C、Mg在反应中均为还原剂,被还原;
③ 在反应I、II中Mg的还原性大于Ti,C的还原性大于TiCl4;
④ a=1,b=c=2;
⑤ 每生成0.1molTi,反应I、II中共转移0.4mole-。
①②④ B.②③④ C.② D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上“中温焙烧——钠化氧化法”回收电镀污泥中的铬已获技术上的突破。其工艺流程如下:
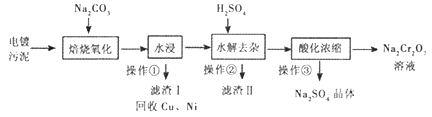
【查阅资料】
①电镀污泥中含有Cr(OH)3、Al203、ZnO、CuO、NiO等物质;水浸后溶液中含有Na2CrO4、NaAlO2、Na2ZnO2等物质;
②Na2CrO4转化成Na2Cr2O7离子反应方程式为:2 CrO42-+2H+=Cr2O72-+H2O;③Na2SO4、Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表:

请回答:
(1)操作①的名称是_______,“水浸”后的溶液呈_______性;
(2)“焙烧氧化”过程中Cr(OH)3转化成Na2CrO4的化学方程式为___________;
(3)滤渣II的主要成分有Zn(OH)2和X,生成X的离子反应方程式__________;
(4)“酸化浓缩”时,需继续加入H2SO4,然后_______、结晶、过滤。继续加入H2SO4目的是__________;
(5)以铬酸钠为原料,电化学法制备重铬酸钠的实验装置如图所示。
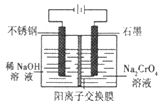
①阴极发生的电极反应式为:_____________;
②若测定阳极液中Na与Cr的物质的量之比值为d,则此时铬酸钠的转化率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用H++OH-=H2O来表示的化学反应是( )。
A.CH3COOH+NaOH==CH3COONa+H2O
B.HNO3+KOH=KNO3+H2O
C.H2SO4+Ba(OH)2=BaSO4↓+2H2O
D.2HCl+Cu(OH)2=CuCl2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应 A2(g) +B2(g)=2AB(g) ΔH,其能量变化如图所示,下列叙述正确的是
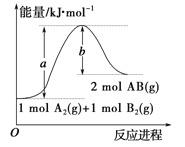
A. 断裂 1 mol A2 和 1 mol B2 中的化学键,放出a kJ 能量
B. ΔH=+(a-b)kJ·mol-1
C. 每生成 2 个AB分子吸收 b kJ 热量
D. 该反应中反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
(1)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol -1
2SO3(g) ΔH=-196.6 kJ·mol -1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1:5,则平衡常数K= 。
(2)下图是一种用NH3脱除烟气中NO的原理。
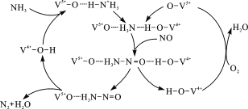
①该脱硝原理中,NO最终转化为H2O和_____________(填化学式)。
②当消耗1 mol NH3和0.5 molO2时,除去的NO在标准状况下的体积为__________L。
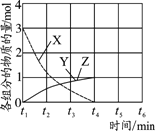
(3)NO直接催化分解(生成N2和O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如右图所示,写出NO分解的化学方程式:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com