
【题目】(题文)(题文)钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。
(1)T℃时,WO3经如下的四步反应生成W。每一步反应的焓变和平衡常数如下:
WO3(s)+0.1H2(g)![]() WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.1H2O(g) △H1 K1
WO2.9(s)+0.18H2(g)![]() WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.18H2O(g) △H2 K2
WO2.72(s)+0.72H2(g)![]() WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+0.72H2O(g) △H3 K3
WO2(s)+2H2(g)![]() W(s)+2H2O(g) △H4 K4
W(s)+2H2O(g) △H4 K4
则该温度下,WO3(s)+3H2(g)![]() W(s)+3H2O(g) K=__________。
W(s)+3H2O(g) K=__________。
(2)T1℃时,将4molH2和足量WO3置于2 L密闭容器中,发生反应:WO3(s)+3H2(g)![]() W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:
W(s)+3H2O(g),混合气体各组分物质的量之比随时间变化的关系如图所示:

①下列选项中能说明反应已经达到平衡的是_________。(填字母)
a.反应速率ν(H2)=ν(H2O)
b.每断裂3molH-H键的同时断裂3molO-H键
c.反应热不变
d.混合气体的密度不再改变
e.体系的压强不再改变
②反应在2min时达到平衡,此时H2的平衡转化率a=_________%。
③若在4min时升高并维持温度为T2℃,变化如图所示,则该反应的△H_______0,若在8min时缩小容器容积,则![]() ________1.3。(填“>”“ <”或“=”)
________1.3。(填“>”“ <”或“=”)
(3)利用电解法可以从合金碳化钨(WC)废料中回收钨元素(合金中钨、碳均为单质)。电解时,用合金碳化钨做阳极,不锈钢做阴极,盐酸溶液为电解液,阳极析出钨酸(H2WO4)并放出CO2。该阳极的电极反应式为___________________________________。
【答案】K1K2K3K4d62.5<=WC+6H2O-10e-=H2WO4↓+CO2↑+10H+
【解析】
(1)①WO3(s)+0.1H2(g)![]() WO2.9(s)+0.1H2O(g) K1
WO2.9(s)+0.1H2O(g) K1
②WO2.9(s)+0.18H2(g)![]() WO2.72(s)+0.18H2O(g) K2 ③WO2.72(s)+0.72H2(g)
WO2.72(s)+0.18H2O(g) K2 ③WO2.72(s)+0.72H2(g)![]() WO2(s)+0.72H2O(g) K3 ④WO2(s)+2H2(g)
WO2(s)+0.72H2O(g) K3 ④WO2(s)+2H2(g)![]() W(s)+2H2O(g) K4;
W(s)+2H2O(g) K4;
①+②+③+④可得WO3(s)+3H2(g)![]() W(s)+3H2O(g);(2)①根据平衡标志分析;②反应在2min时达到平衡,
W(s)+3H2O(g);(2)①根据平衡标志分析;②反应在2min时达到平衡, ![]() ,利用“三段式”计算H2的平衡转化率。③若在4min时升高并维持温度为T2℃,
,利用“三段式”计算H2的平衡转化率。③若在4min时升高并维持温度为T2℃,![]() 增大,说明平衡逆向移动;反应前后气体物质的量不变,若在8min时缩小容器容积平衡不移动。(3)阳极碳化钨失电子发生氧化反应生成钨酸和二氧化碳。
增大,说明平衡逆向移动;反应前后气体物质的量不变,若在8min时缩小容器容积平衡不移动。(3)阳极碳化钨失电子发生氧化反应生成钨酸和二氧化碳。
(1)①WO3(s)+0.1H2(g)![]() WO2.9(s)+0.1H2O(g) K1
WO2.9(s)+0.1H2O(g) K1
②WO2.9(s)+0.18H2(g)![]() WO2.72(s)+0.18H2O(g) K2
WO2.72(s)+0.18H2O(g) K2
③WO2.72(s)+0.72H2(g)![]() WO2(s)+0.72H2O(g) K3
WO2(s)+0.72H2O(g) K3
④WO2(s)+2H2(g)![]() W(s)+2H2O(g) K4
W(s)+2H2O(g) K4
则该温度下,①+②+③+④可得WO3(s)+3H2(g)![]() W(s)+3H2O(g),所以K= K1K2K3K4;(2)①a.反应速率ν(H2)、ν(H2O)都是指正反应,ν(H2)=ν(H2O)不一定平衡,故a错误; b.每断裂3molH-H键的同时断裂3molO-H键,正逆反应速率比不等于系数比,不一定平衡,故b错误; c.焓变与反应方程式的系数有关,反应热不变,不一定平衡,故c错误; d.反应前后气体质量是变量、气体物质的量不变,根据
W(s)+3H2O(g),所以K= K1K2K3K4;(2)①a.反应速率ν(H2)、ν(H2O)都是指正反应,ν(H2)=ν(H2O)不一定平衡,故a错误; b.每断裂3molH-H键的同时断裂3molO-H键,正逆反应速率比不等于系数比,不一定平衡,故b错误; c.焓变与反应方程式的系数有关,反应热不变,不一定平衡,故c错误; d.反应前后气体质量是变量、气体物质的量不变,根据![]() ,密度是变量,混合气体的密度不再改变一定平衡,故d正确; e.反应前后气体物质的量不变,压强是恒量,体系的压强不再改变不一定平衡,故e错误。②反应在2min时达到平衡,
,密度是变量,混合气体的密度不再改变一定平衡,故d正确; e.反应前后气体物质的量不变,压强是恒量,体系的压强不再改变不一定平衡,故e错误。②反应在2min时达到平衡, ![]() ,
,
WO3(s)+3H2(g)![]() W(s)+3H2O(g)
W(s)+3H2O(g)
始 4 0 ;
转 /span> x x
平 4-x x
![]() , x=2.5
, x=2.5
H2的平衡转化率a=![]() ;③若在4min时升高并维持温度为T2℃,
;③若在4min时升高并维持温度为T2℃,![]() 增大,说明平衡逆向移动,则该反应的△H<0;反应前后气体物质的量不变,若在8min时缩小容器容积,平衡不移动,所以
增大,说明平衡逆向移动,则该反应的△H<0;反应前后气体物质的量不变,若在8min时缩小容器容积,平衡不移动,所以![]() =1.3。(3)(3)阳极碳化钨失电子发生氧化反应生成钨酸和二氧化碳,阳极反应式是WC+6H2O-10e-=H2WO4↓+CO2↑+10H+。
=1.3。(3)(3)阳极碳化钨失电子发生氧化反应生成钨酸和二氧化碳,阳极反应式是WC+6H2O-10e-=H2WO4↓+CO2↑+10H+。


科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径和主要化合价见下表,下列有关说法中,正确的是( )

A. 等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多
B. Y与Q形成的化合物不可能跟氢氧化钠溶液反应
C. Z的氢化物的稳定性强于L的氢化物的稳定性
D. 与稀盐酸反应的剧烈程度:M单质<X单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】邻苯二甲醛(D)在碱性条件下发生歧化(即自身氧化还原)反应,再经酸化得到化合物E,E可在浓硫酸存在的条件下生成含五元环的化合物F,下列说法正确的是( )
A. 邻二甲苯可作生产D的原料
B. E可发生银镜反应
C. E可与FeCl3发生显色反应
D. F与D的相对分子质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①蛋白质 ②维生素C ③葡萄糖 ④纤维素四种物质中
(1)不能水解的糖类是_________(填序号,下同);
(2)能水解生成氨基酸的是_________;
(3)在人体中不能直接被消化吸收的是_________;
(4)广泛存在于新鲜蔬菜和水果中,称为抗坏血性酸的是_________,其结构简式为, 则分子式为_________。
则分子式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 丙烯分子所有原子均在同一平面上
B. 向溴水中分别通入乙烯加入苯,都能观察到溴水褪色现象,但原因不同
C. C4H4只有![]() 和CH
和CH![]() C—CH=CH2两种同分异构体
C—CH=CH2两种同分异构体
D. 芳香烃![]() 和
和![]() 的一氯代物都只有2种
的一氯代物都只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)曲酸是一种非常有潜力的食品添加剂,经测定曲酸的分子式为C6H6O4,结构简式为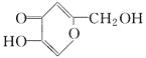 ,其所含有的官能团有(写结构简式) __________。
,其所含有的官能团有(写结构简式) __________。
(2)L­多巴用于帕金森综合症的治疗,其结构简式为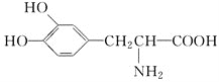 。这种药物的研制是基于获得2000年诺贝尔生理学和医学奖的研究成果。L­多巴分子中所含的官能团的名称是__________。
。这种药物的研制是基于获得2000年诺贝尔生理学和医学奖的研究成果。L­多巴分子中所含的官能团的名称是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中可以大量共存的是( )
A.K+、Na+、HCO3-、OH-B.Fe2+、NO3-、Cl-、Na+
C.Al3+、Mg2+、NO3-、OH-D.H+、K+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)+3价Co的配合物CoClm·nNH3,中心原子的配位数为6,若1 mol该配合物与足量AgNO3溶液反应生成1 mol AgCl沉淀,用配合物形式写出该配合物的化学式 。
(2)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大磁记录性能越好。离子型氧化物MnO2和Fe3O4及Cr2O3中,磁性最大的是___________。
(3)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨(如下左图),每个碳原子通过 杂化与周围碳原子成键。
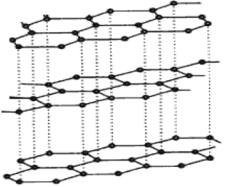
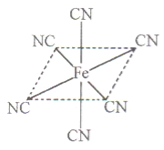
(4)铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如上右图。
①已知CN—与N2结构相似,1molCN-中![]() 键数目为 。
键数目为 。
②上述沉淀溶解过程的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com