
【题目】元素的性质呈现周期性变化的根本原因是
A. 原子半径呈周期性变化
B. 元素的化合价呈周期性变化
C. 第一电离能呈周期性变化
D. 元素原子的核外电子排布呈周期性变化
科目:高中化学 来源: 题型:
【题目】PEI [ ]是一种非结晶性塑料。其合成路线如下(某些反应条件和试剂已略去):
]是一种非结晶性塑料。其合成路线如下(某些反应条件和试剂已略去):

已知:
(1)A为链状烃。A的化学名称为______。
(2)A→B的反应类型为______。
(3)下列关于D的说法中正确的是______(填字母)。
a.不存在碳碳双键
b.可作聚合物的单体
c.常温下能与水混溶
(4)F由4-氯-1,2-二甲苯催化氧化制得。F所含官能团有-Cl和______。
(5)C的核磁共振氢谱中,只有一个吸收峰。仅以2-溴丙烷为有机原料,选用必要的无机试剂也能合成C写出有关化学方程式:______。
(6)F→K 的反应过程中有多种副产物。其中一种含有3个环的有机物的结构简式是___。
(7)以E和K为原料合成PEI分为三步反应。

写出中间产物1、中间产物2的结构简式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】巳知:25℃时某些弱酸的电离平衡常数。下面图像表示常温下稀释CH3COOH、HClO两种酸的稀溶液时、溶液pH随加水量的变化,下列说法正确的是
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-3 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
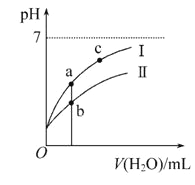
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-
C. 图像中a点酸的总浓度大于b点酸的总浓度
D. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T1℃时,向容积为2L的密闭容器中充入一定量的A气体和B气体,发生如下反应:A(g) +2B(g)![]() C(p)。反应过程中测定的部分数据见下表:
C(p)。反应过程中测定的部分数据见下表:
反应时间/min | n(A)/mol | n(B)/ mol |
0 | 1.00 | 1.20 |
10 | 0.50 | |
30 | 0.20 |
下列说法错误的是
A. 前10min内反应的平均速率为v(C)=0.0250 mnol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.50molA气体和0.60mo1B气体,到达平衡时,n(C)<0.25mo1
C. 其他条件不变时,向平衡体系中再充入0.50molA,与原平衡相比,达平衡时B的转化率增大,A的体积分数增大
D. 温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙变红色的溶液:Al3+、Cu2+、I-、S2O32-
B. 常温下,加水冲稀时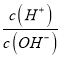 的值明显增大的溶液:CH3COO-、Ba2+、NO3-、Br-
的值明显增大的溶液:CH3COO-、Ba2+、NO3-、Br-
C. 0.1mol·L-1Fe(NO3)2溶液:[Fe(CN)6]3-、Na+、SO42-、Cl-
D. 加入铝粉放出氢气的溶液:K+、Cl-、Mg2+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如下图所示。
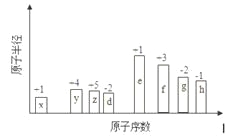
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的大小(用化学式表示,下同)_______>__________;比较g、h
的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. Na2CO3水解的主要产物有CO2
B. 醋酸铵溶液呈中性,是由于醋酸铵不会发生水解
C. 盐的水解可视为中和反应的逆反应
D. 某些盐的水溶液呈中性,这些盐一定是强酸强碱盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,能在溶液中大量共存且溶液呈透明的是( )
A.Mg2+ 、H+ 、Cu2+ 、SO42-B.Ba2+ 、NO3- 、OH- 、CO32--
C.Ag+ 、H+ 、Cl- 、NO3-D.K+ 、H+ 、Cl- 、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com