
【题目】下列各组离子,能在溶液中大量共存且溶液呈透明的是( )
A.Mg2+ 、H+ 、Cu2+ 、SO42-B.Ba2+ 、NO3- 、OH- 、CO32--
C.Ag+ 、H+ 、Cl- 、NO3-D.K+ 、H+ 、Cl- 、CO32-
科目:高中化学 来源: 题型:
【题目】元素的性质呈现周期性变化的根本原因是
A. 原子半径呈周期性变化
B. 元素的化合价呈周期性变化
C. 第一电离能呈周期性变化
D. 元素原子的核外电子排布呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是:
A. CO2分子的球棍模型:![]() B. 14N 的原子结构示意图:
B. 14N 的原子结构示意图:![]()
C. CH4分子的比例模型:  D. 质子数为6,中子数为8 的核素:l4C
D. 质子数为6,中子数为8 的核素:l4C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的体检指标中,表示总胆红素指标的物理量是( )
项目名称 结果 单位 参考值
1谷丙转氨酶 7 U/L <40
2谷草转氨酶 16 U/L 0-40
3谷酰转肽酶 15 U/L 0-50
4碱性磷酸酶 77 U/L 34-114
5总胆红素 12.3 mmol/L 0-19
A.质量分数B.溶解度C.摩尔质量D.物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F可以用于制备高吸水性树脂聚丙烯酸钠,其合成路线如下:

请回答:
(1)D→E的反应类型_______反应。
(2)F中所含官能团的名称是______。
(3)试剂a是______。
(4)B→C的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法不正确的是
A. 15.6gNa2O2与过量CO2反应时,转移的电子数为0.2NA
B. 常温下,5.6g铁粉加入足量浓硝酸中反应,转移的电子数为0.3 NA
C. 常温下,4gCH4含有NA个C-H共价键
D. 分子总数为NA的ClO2和CO2混合气体中含有的氧原子数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
2HNO3+4N2+9H2O,在反应中被氧化与被还原的氮原子数之比为( )
A. 5∶3 B. 5∶4 C. 1∶1 D. 3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过实验研究钠及其化合物的有关性质,请回答相关问题.
(1)实验室中少量的钠通常保存在_______中,在实验室中取用钠的仪器是________.
(2)若将钠在空气中加热,钠会燃烧发出黄色火焰,同时生成 色的固体,写出该产物与H2O反应的化学方程式:________.
(3)将金属钠投入水中,发生反应的离子方程式为________
(4)该同学在实验室欲配制500mL0.1mol/L NaOH溶液.
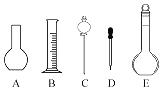
①配制溶液时肯定不需要如图所示仪器中的________(填字母),配制上述溶液还需要用到的玻璃仪器是________(填仪器名称).
②根据计算,该同学应用托盘天平称取NaOH的质量为________.
③该同学将所配制的NaOH溶液进行测定,发现浓度大于0.1mol/L.下列操作会引起所配浓度偏大的是________.
A.烧杯未进行洗涤
B.配制前,容量瓶中有少量蒸馏水
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如图:
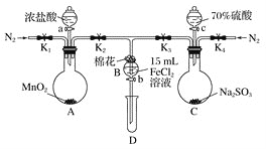
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T形导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是________________________。
(2)棉花中浸润的溶液为__________________。作用是_______________________。
(3)A中发生反应的化学方程式:______________________________________。
(4)导致步骤Ⅲ中溶液变黄的离子反应是______________________________。用______________(写试剂化学式)检验氧化产物,现象是___________________________。
(5)能说明氧化性Fe3+>SO2的离子方程式是__________________________。
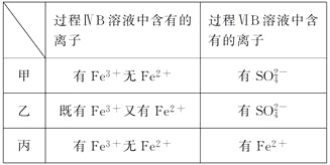
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是________________(填“甲”“乙”或“丙”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com