
【题目】下列化学用语表示正确的是:
A. CO2分子的球棍模型:![]() B. 14N 的原子结构示意图:
B. 14N 的原子结构示意图:![]()
C. CH4分子的比例模型:  D. 质子数为6,中子数为8 的核素:l4C
D. 质子数为6,中子数为8 的核素:l4C
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】巳知:25℃时某些弱酸的电离平衡常数。下面图像表示常温下稀释CH3COOH、HClO两种酸的稀溶液时、溶液pH随加水量的变化,下列说法正确的是
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-3 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
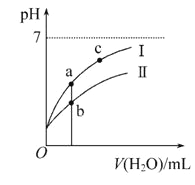
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-
C. 图像中a点酸的总浓度大于b点酸的总浓度
D. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. Na2CO3水解的主要产物有CO2
B. 醋酸铵溶液呈中性,是由于醋酸铵不会发生水解
C. 盐的水解可视为中和反应的逆反应
D. 某些盐的水溶液呈中性,这些盐一定是强酸强碱盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些硼化合物在工业上有许多用途。以铁硼矿为原料可以制得硼酸及其他硼化合物。回答下列问题:
(1)硼酸(H3BO3)为一元酸,硼酸中B的化合价为__________________。
(2)已知:Ka(H3BO3)=5.8×10-l0,Ka(H2CO3)=4.4×10-7,Ka(HCO3-)=4.7×10-l1,向饱和硼酸溶液中滴加0.1 molL-1Na2CO3溶液,____________(填“能”或“不能”)观察到气泡逸出。写出该反应的化学方程式____________________________________。
(3)以硼酸为原料可制备重要还原剂NaBH4,BH4-的电子式为______________。NaBH4与BF3在50℃~70℃反应生成NaBF4和乙硼烷(B2H6),该反应的化学方程式是___________________________。
(4)硫酸溶解铁硼矿可制得含Fe3+、Fe2+、Al3+杂质的硼酸溶液,提纯过程中加入H2O2的目的是____________________,为除去Fe3+、Al3+ (使其浓度均小于1×10-6 mol·L-1),需至少调节pH=_________(已知: Ksp[Al(OH)3]= 1×10-33,Ksp[Fe(OH)3]=4×10-38)
(5)H3BO3可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
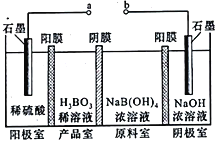
①a接电源的____________ (填“正极”、“ 负极”)
②写出阳极的电极反应式__________________________________。
③原料室中阴、阳离子是如何迁移的?_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在元素周期表中处于A、B位置的某些元素性质相似,这称为“对角线规则”。A为铍(Be),原子序数为4,B为铝(Al),下列有关其性质的推断正确的是
![]()
A. 铍能与冷水发生剧烈反应
B. 氢氧化铍既能与强酸溶液反应,又能与强碱溶液反应
C. 氢氧化铍的化学式为Be(OH)3
D. 氢氧化铍易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稠环芳香烃是指两个或两个以上的苯环通过共用环边所构成的多环有机化合物。常见的稠环芳香烃如萘、蒽、菲、芘等,其结构分别为
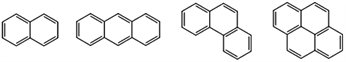
萘 蒽 菲 芘
下列说法不正确的是
A. 萘的分子式为C10H8,与H2完全加成后,产物的分子式为C10H18
B. 蒽、菲、芘的一氯代物分别有3种、5种、5种
C. 上述四种物质的分子中,所有碳原子均共平面
D. 上述四种物质均可与浓硝酸发生硝化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,能在溶液中大量共存且溶液呈透明的是( )
A.Mg2+ 、H+ 、Cu2+ 、SO42-B.Ba2+ 、NO3- 、OH- 、CO32--
C.Ag+ 、H+ 、Cl- 、NO3-D.K+ 、H+ 、Cl- 、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保险粉又称连二亚硫酸钠(Na2S2O4),可用于纺织工业的漂白剂、脱色剂,脱氯剂。Na2S2O4是白色粉末,无味,易溶于水、难溶于乙醇,具有极强的还原性,在空气中易被氧化,在碱性介质中稳定。
Ⅰ.甲酸钠(HCOONa)法制备过程如下:

(1)连二亚硫酸钠中硫元素的化合价为______________。
(2)实验室用Na2SO3 固体和某酸反应制备SO2气体,制备SO2时所选用的酸,你认为下列最适宜选用的是______________。
A.浓盐酸 B.浓硝酸
C.质量分数为70%的硫酸 D.质量分数为10%的硫酸
(3)步骤①中制备连二亚硫酸钠的化学方程式可表示为____________________________。
(4)上述步骤②中,加入适量乙醇水溶液的作用是______________。
(5)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是_________________________。
(6)①现将0.05mol/L Na2S2O4溶液在空气中放置,其溶液的pH 与时间(t)的关系如图所示。

t1时溶液中只有NaHSO3一种溶质,此时含硫元素的粒子浓度由大到小的顺序为_______________。
②t1~t2段发生化学反应的离子方程式为______________________________。
Ⅱ.电解法制备:工业上用惰性电极电解NaHSO3溶液得到Na2S2O4。过程如图所示

(7)①产品在_________________(填“阳极”、“阴极”)得到。
②若不加隔膜,则连二亚硫酸钠产率降低,其原因是__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com