
【题目】随原子序数的递增,八种短周期元素原子半径的相对大小、最高正价或最低负价的变化如下图所示。
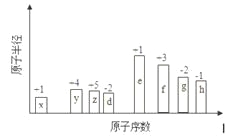
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的大小(用化学式表示,下同)_______>__________;比较g、h
的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
【答案】(1)第三周期第IIIA族 (2)O2->Na+;HClO4>H2SO4(3)NH3AlCl3HCHO
【解析】试题分析:x的化合价是+1价,原子半径最小,则x是H。y的化合价是+4价,则y是C,以此类推z是N,d是O,e是Na,f是Al,g是S,h是Cl。
(1)Al的原子序数是13,在元素周期表的位置是第三周期第IIIA族。
(2)核外电子排布相同的离子,其离子半径随原子序数的增大而减小,则d、e常见离子的半径的大小去O2->Na+;非金属性越强,最高价含氧酸的酸性越强,则g、h的最高价氧化物对应的水化物的酸性强弱是HClO4>H2SO4。
(3)上述元素组成一种四原子共价化合物可以是氨气,电子式为![]() 。
。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】苯乙酸铜是合成优良催化剂、传感材料纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:


制备苯乙酸的装置如右图所示(加热和夹持装置等略),已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。回答下列问题:(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是_____________________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是______________;仪器c的名称是__________,其作用是__________________。反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是_______。下列仪器中可用于分离苯乙酸粗品的是___________(填标号)。
A.分液漏斗 B.漏斗C.烧杯 D.直形冷凝管 E.玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证同主族元素性质的递变规律。某小组用如图所示的装置进行实验(夹持仪器已略去,装置气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当装置B和装置C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当装置B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)浸有NaOH溶液的棉花的作用____________________________。
(2)装置A中发生的置换反应的化学方程式为___________________。
(3)装置B的溶液中NaBr完全被氧化,则消耗Cl2的物质的量为__________。
(4)为验证溴元素的非金属性强于碘元素,过程Ⅳ的操作和现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在多年前就探测到火星大气中存在微量的羰基硫(OCS)。已知有关OCS的反应有CO+S![]() OCS,2OCS+SO2
OCS,2OCS+SO2![]() 2CO2+3S。下列说法不正确的是( )
2CO2+3S。下列说法不正确的是( )
A. CO2分子中每个原子最外层都达到了8电子稳定结构 B. 原子半径:S>C>O
C. OCS和CO2都含离子键 D. OCS属于共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的性质呈现周期性变化的根本原因是
A. 原子半径呈周期性变化
B. 元素的化合价呈周期性变化
C. 第一电离能呈周期性变化
D. 元素原子的核外电子排布呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:

已知:
![]()
(1)A属于芳香烃,其名称是___________________。
(2)B的结构简式是____________________________。
(3)由C生成D的化学方程式是___________________________________________。
(4)由E与I2在一定条件下反应生成F的化学方程式是____________________________;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是_____________________________________。
(5)试剂b是_____________________________。
(6)下列说法正确的是___________(选填字母序号)。
a. G存在顺反异构体
b. 由G生成H的反应是加成反应
c. 1 mol G最多可以与1 mol H2发生加成反应
d. 1 mol F或1 mol H与足量NaOH溶液反应,均消耗2 molNaOH
(7)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成,写出合成 的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_______。
的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32﹣、SO42﹣、Cl﹣中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 原溶液一定存在CO32﹣和SO42﹣,一定不存在Fe3+
B. 原溶液一定存在Cl﹣,可能存在Na+
C. 原溶液中c(Cl﹣)≥0.1molL﹣1
D. 若原溶液中不存在Na+,则c(Cl﹣)<0.1molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属,以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
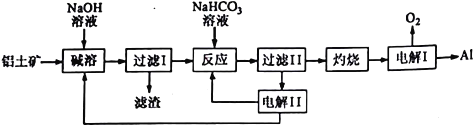
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)A1的原子结构示意图为_______________;A1与NaOH溶液反应的离子方程式为______________________________________。
(2) “碱溶”时生成偏铝酸钠的离子方程式为_______________________________。
(3)向” 过滤Ⅰ所得滤液中加入NaHCO3溶液,溶液的pH_________(填“增大”、“ 不变”或“减小”)。
(4) “电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是__________________。
(5)”电解Ⅱ原理如图所示。
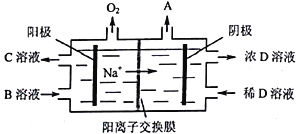
①试写出A、B、C、D物质的化学式:A_______,B_______,C_______,D_______。
②阳极的电极反应式为______________________________。
(6)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA。下列说法不正确的是
A. 15.6gNa2O2与过量CO2反应时,转移的电子数为0.2NA
B. 常温下,5.6g铁粉加入足量浓硝酸中反应,转移的电子数为0.3 NA
C. 常温下,4gCH4含有NA个C-H共价键
D. 分子总数为NA的ClO2和CO2混合气体中含有的氧原子数为2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com