
【题目】Na2CO3与NaHCO3在生产、生活中用途非常广泛,同学们在实验室中探究Na2CO3和NaHCO3的性质。称取Na2CO3、NaHCO3固体各2g,分别加入两支大试管中,再各加10mL蒸馏水,充分溶解后,恢复至室温,各滴入2滴酚酞溶液,观察到如图所示现象。

(1)下列说法中,正确的是_____(填字母序号)。
a.两溶液中所含分子、离子种类完全相同
b.左侧试管中的现象解释了Na2CO3的俗名为什么叫做“纯碱”
c.向两支试管中加入过量硼酸饱和溶液,均有无色气体生成
(2)两溶液中的离子浓度都存在下式的数量关系,请你补充完整:c(Na+)+c(H+)=_____。
(3)NaHCO3溶液中存在下列两种变化趋势:
变化i.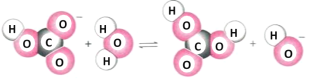
变化ii.(用离子方程式表示)_____。
溶液中滴加酚酞变为粉色,是因为以_____为主(填“变化i”或“变化ii”)。
【答案】ab 2c(CO32-)+c(HCO3-)+c(OH-) HCO3-![]() CO32-+H+ 变化i
CO32-+H+ 变化i
【解析】
质量相同的Na2CO3、NaHCO3加相同量的水,Na2CO3完全溶解,NaHCO3有部分未溶解,说明溶解度:Na2CO3>NaHCO3;
Na2CO3溶液加酚酞变红色,NaHCO3溶液加酚酞变粉色,说明二者都显碱性,且碱性:Na2CO3>NaHCO3,二者显碱性的原因是CO32-和HCO3-都会水解,且水解程度:CO32->HCO3-。
(1)a.Na2CO3溶液存在3个平衡,水解平衡:CO32-+H2O![]() HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O![]() H2CO3+OH-,水的电离:H2O
H2CO3+OH-,水的电离:H2O![]() H++OH-,所以Na2CO3溶液中含Na+、CO32-、HCO3-、H+、OH-共5种离子,H2O、H2CO3共2种分子。NaHCO3溶液存在3个平衡,水解平衡:HCO3-+H2O
H++OH-,所以Na2CO3溶液中含Na+、CO32-、HCO3-、H+、OH-共5种离子,H2O、H2CO3共2种分子。NaHCO3溶液存在3个平衡,水解平衡:HCO3-+H2O![]() H2CO3+OH-,电离平衡:HCO3-
H2CO3+OH-,电离平衡:HCO3-![]() CO32-+H+、H2O
CO32-+H+、H2O![]() H++OH-,所以NaHCO3溶液中含Na+、CO32-、HCO3-、H+、OH-共5种离子,H2O、H2CO3共2种分子,故a正确;
H++OH-,所以NaHCO3溶液中含Na+、CO32-、HCO3-、H+、OH-共5种离子,H2O、H2CO3共2种分子,故a正确;
b.Na2CO3属于盐,但其水溶液具有较强碱性,所以俗名纯碱,故b正确;
c.酸性:碳酸>硼酸,向两支试管中加入过量硼酸饱和溶液,均不可能产生气体,故c错误;
故答案为:ab;
(2)两溶液中的离子浓度都存在电荷守恒关系:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故答案为:2c(CO32-)+c(HCO3-)+c(OH-);
(3)NaHCO3溶液中存在HCO3-的水解和电离两种趋势,图示为HCO3-的水解,故另一种为电离趋势,其电离方程式为:HCO3-![]() CO32-+H+,滴加酚酞变为粉色,说明NaHCO3溶液显碱性,所以HCO3-的水解程度大于电离程度,即以水解为主,故答案为:HCO3-
CO32-+H+,滴加酚酞变为粉色,说明NaHCO3溶液显碱性,所以HCO3-的水解程度大于电离程度,即以水解为主,故答案为:HCO3-![]() CO32-+H+;变化i。
CO32-+H+;变化i。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】1g H2燃烧生成液态水放出142.9 kJ的热量,下列热化学方程式书写正确的是( )
A.2H2(g)+ O2(g) = 2H2O (1), ΔH = -142.9 kJ·mol-1
B.2H2(g)+ O2(g) = 2H2O (1), ΔH = -571.6 kJ·mol-1
C.2H2+O2= 2H2O, ΔH = -571.6 kJ·mol-1
D.H2(g)+![]() O2(g) = H2O (1), ΔH = +285.8 kJ·mol-1
O2(g) = H2O (1), ΔH = +285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取试剂级NaCl及回收金属Mg的工业流程如图:
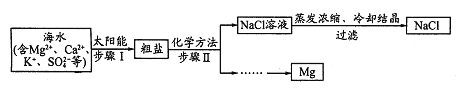
![]() 步骤I原理如图,在实验室中完成该步骤所用装置为 ______
步骤I原理如图,在实验室中完成该步骤所用装置为 ______ ![]() 填序号
填序号![]() 。
。
![]() 某学习小组设计了实验模拟步骤Ⅱ:
某学习小组设计了实验模拟步骤Ⅱ:
粗盐溶解![]() 过滤
过滤![]() NaCl溶液
NaCl溶液
![]() 该实验中加入
该实验中加入![]() 的作用是 ______ ;若向粗盐溶液中加入的是
的作用是 ______ ;若向粗盐溶液中加入的是![]() 浓溶液,则有难溶的
浓溶液,则有难溶的![]() 生成,同时有气体逸出.该反应的离子方程式为 ______。
生成,同时有气体逸出.该反应的离子方程式为 ______。
![]() 学习小组发现上述实验即使
学习小组发现上述实验即使![]() 用量不足,第
用量不足,第![]() 步沉淀中依然含有少量
步沉淀中依然含有少量![]() ,试从平衡角度分析 ______。
,试从平衡角度分析 ______。
![]() 在第
在第![]() 步后增加过滤,并从滤渣中得到
步后增加过滤,并从滤渣中得到![]() ,工业上通过电解获得Mg的化学方程式为 ______ ; 若
,工业上通过电解获得Mg的化学方程式为 ______ ; 若![]() 时直接将
时直接将![]() 熔融,然后用惰性电极电解,发现有固体剩余,则该固体可能是 ______
熔融,然后用惰性电极电解,发现有固体剩余,则该固体可能是 ______ ![]() 写化学式
写化学式![]() ;现有a g滤渣,用上二述方法处理回收Mg时产生标况下
;现有a g滤渣,用上二述方法处理回收Mg时产生标况下![]() ,剩余固体为c g。则滤渣中镁元素的质量分数为
,剩余固体为c g。则滤渣中镁元素的质量分数为 ![]() 不必化简
不必化简![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
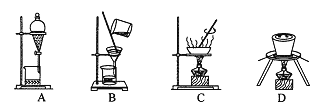
【题目】(1)从含碘的有机溶液中提取碘和回收有机溶剂需要经过蒸馏操作,指出下图蒸馏装置中的错误之处并改正。

①____________________________________;
②____________________________________;
③____________________________________。
(2)上述有机溶剂为CC14(沸点为76. 8 ℃),进行上述蒸馏操作时,使用水浴加热的目的是________,最后晶体碘在______________中聚集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化锌![]() 是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如图所示。
是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如图所示。
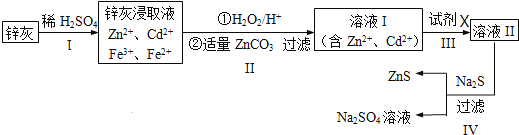
![]() 为提高锌灰的浸取率,不宜采用的方法是______
为提高锌灰的浸取率,不宜采用的方法是______![]() 填序号
填序号![]() 。
。
![]() 研磨
研磨 ![]() 多次浸取
多次浸取 ![]() 升高温度
升高温度 ![]() 加压
加压 ![]() 搅拌
搅拌
![]() 步骤Ⅱ中
步骤Ⅱ中![]() 的作用是______,所得滤渣的主要成分是______
的作用是______,所得滤渣的主要成分是______![]() 写化学式
写化学式![]() 。
。
![]() 步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂X应为______。
步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂X应为______。
![]() 步骤Ⅳ还可以回收
步骤Ⅳ还可以回收![]() 来制取
来制取![]() 。
。
![]() 检验ZnS固体是否洗涤干净的方法是______。
检验ZnS固体是否洗涤干净的方法是______。
![]() 可由等物质的量的
可由等物质的量的![]() 和
和![]() 在高温、催化剂条件下制取,化学反应方程式为______。
在高温、催化剂条件下制取,化学反应方程式为______。
![]() 若步骤Ⅱ加入的
若步骤Ⅱ加入的![]() 为b mol,步骤Ⅲ所得Cd为d mol,最后得到V L,c
为b mol,步骤Ⅲ所得Cd为d mol,最后得到V L,c ![]() 的
的![]() 溶液。则理论上所用锌灰中含有锌元素的质量为______。
溶液。则理论上所用锌灰中含有锌元素的质量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如图所示(部分反应条件已略去)。

已知;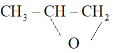 与
与![]() 反应生成
反应生成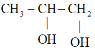 。
。
(1)A的化学名称是________________。
(2)B和A反应生成C的化学方程式为________________,该反应的类型为________________。
(3)D的结构简式为________________。
(4)F的结构简式为________________。
(5)D的同分异构体的结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁“发蓝”是指在钢铁的表面形成一层四氧化三铁的技术过程。其中第一步反应为:3Fe+ NaNO2+ 5 NaOH= 3Na2FeO2+ H2O+ NH3↑。关于该反应说法正确的是![]()
A.反应中N元素被氧化
B.NaFeO2既是氧化产物也是还原产物
C.整个反应过程中每有![]() 参加反应就转移
参加反应就转移![]() 电子
电子
D.氧化剂与还原剂的物质的量之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢卤酸的能量关系如图所示下列说法正确的是

A. 已知HF气体溶于水放热,则HF的△H1<0
B. 相同条件下,HCl的△H2比HBr的小
C. 相同条件下,HCl的△H3+△H4比HI的大
D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】痛风病与关节滑液中形成的尿酸钠(NaUr)有关(NaUr增多,病情加重),其化学原理为:HUr(aq) + Na+ (aq)NaUr(s) + H+(aq)ΔH<0,下列说法不正确的是
A.炎热的夏季更易诱发关节疼痛
B.饮食中摄入过多食盐,会加重痛风病病情
C.患痛风病的人应少吃能代谢产生更多尿酸(HUr)的食物
D.大量饮水使 ![]() 增大,痛风病发作的可能性减小
增大,痛风病发作的可能性减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com