
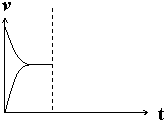
| △c |
| t |
| △c |
| t |
| 1-0.8 |
| 10 |
| 1 |
| 2 |
| 0.25×0.25 |
| 0.52 |
(1-
| ||
| x2 |
| 1 |
| 2 |


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
2- 4 |
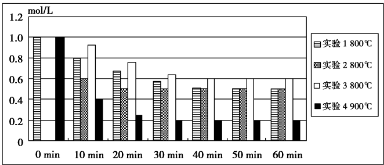
查看答案和解析>>
科目:高中化学 来源: 题型:
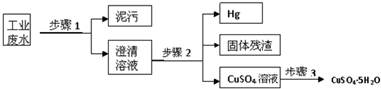
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.粉末中一定有Na20、Na202、NaHC03 |
| B、.粉末中一定不含有Na2C03和NaCl |
| C、粉末中一定不含有Na20和NaCl |
| D、.无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
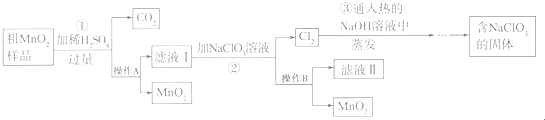
 在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入几滴CuSO4溶液 |
| B、加入少量6mol/L的稀盐酸 |
| C、升高温度 |
| D、不用稀硫酸,改用浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com