
| A、升高温度 | B、使用催化剂 |
| C、增大压强 | D、增加浓度 |
科目:高中化学 来源: 题型:
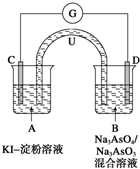
查看答案和解析>>
科目:高中化学 来源: 题型:
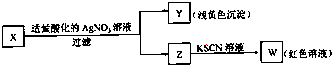
| A、加入适量酸化的AgNO3溶液只发生复分解反应 |
| B、X中一定有Fe3+ |
| C、将操作顺序调换,现象一致,可判断X为FeBr3 |
| D、X一定为FeBr2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
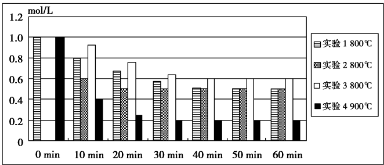
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨工业中及时将NH3液化分离,可加快反应速率,并提高N2、H2的转化率 |
| B、向汽油中添加甲醇后,该混合燃料的热值不变 |
| C、氯碱工业中采用阴离子交换膜法,可防止阴极产生的Cl2和阳极产生的碱反应 |
| D、目前淡化海水的方法有多种,其中蒸馏法历时最久,成本最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大 | B、减小 |
| C、不变 | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水可使无色酚酞试纸先变红,后褪色 |
| B、新制的氯水只含Cl2和H2O分子 |
| C、氯水放置数天后,酸性增强 |
| D、光照氯水有气泡逸出,该气体是Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com