
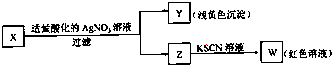
| A、加入适量酸化的AgNO3溶液只发生复分解反应 |
| B、X中一定有Fe3+ |
| C、将操作顺序调换,现象一致,可判断X为FeBr3 |
| D、X一定为FeBr2溶液 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
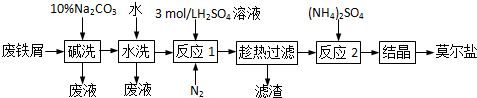
| 4.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
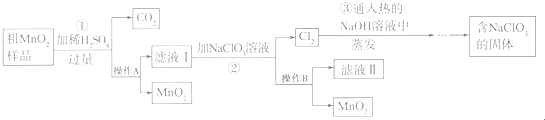
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、鉴定蔗糖酸性水解产物中有葡萄糖:直接在水解液中加入新制Cu(OH)2悬浊液,加热 |
| B、鉴别织物成分是真丝还是人造丝:用灼烧的方法 |
| C、鉴别乙醇、乙酸和乙酸乙酯:用碳酸钠溶液 |
| D、实验室制溴苯:将苯、液溴和铁粉混合即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.粉末中一定有Na20、Na202、NaHC03 |
| B、.粉末中一定不含有Na2C03和NaCl |
| C、粉末中一定不含有Na20和NaCl |
| D、.无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)
在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 L 0.1 mol?L-1CuSO4?(NH4)2SO4?6H2O的溶液中:c(NH4+)>c(SO42-)>c(Cu2+)>c(H+)>c(OH-) |
| B、0.2 mol?L-1NH4NO3和0.l mol?L-1 NaOH溶液等体积混合后:c(NO3-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
| C、0.1 mol?L-1 NaHCO3溶液中:c(Na+)+c(H+)<c(HCO3-)+c(CO32-)+c(H2CO3)+c(OH-) |
| D、等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com